
2020年9月18日にスタジオジブリ作品の場面写真が公開されました。
「常識の範囲内でご自由にお使いください。」とのことで、Twitterでも「#ジブリで学ぶ~」シリーズが色々と発信され、かなり盛り上がりを見せています。
そこで、今回は、「#ジブリで学ぶ臨床開発」について、まとめてみました。
これから臨床開発のお仕事を目指す就活生など治験のことをあまり知らない方にも分かるように簡単な説明を加えながらご紹介をしていきますので是非ご覧下さい!
#ジブリで学ぶ臨床開発
このタグを使っての最初の発信は9月22日のApril(@April15593169)さんでした。
そこから本記事をまとめている10月3日現在で81件もの「#ジブリで学ぶ臨床開発」が投稿されており、臨床開発界隈でもブーム化している状況と言えます。
投稿者を見てみると、メーカーで働いている方からCROで働いている方、SMOで働いている方、そして医療機関で働いている方まで幅広い層の投稿があります。
投稿の内容は、日常的なことを記載したものからトラブル発生時の状況など非常にバリエーション豊か。
どれも秀逸な作品ばかりですが、今回は9月24日までに投稿された約40件についてCRA目線とCRCさん目線に分けてまとめてみました。
治験の現場のおおまかな登場人物を簡単に下の絵にまとめているので、業界のことをあまり知らない方は、下の絵のようなイメージを最初に持ってもらった方が楽しんで見られるかもしれません。(実際にはもっと登場人物はいますが、とりあえずこれくらい知っておけば大丈夫かなというものです)
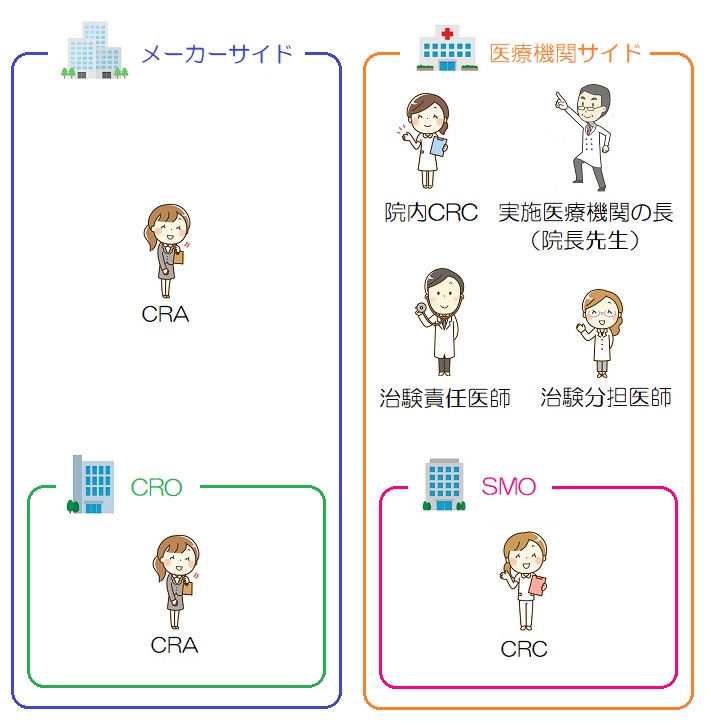
メーカーサイドの視点
では、最初にメーカーサイドからの視点でのツイートを見ていきましょう。
どんなツイートをされているのでしょうね。
日常系
付箋、あ、ここにも付箋。ここにも付箋。ぺたぺた pic.twitter.com/3dyxnGPrdC
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 23, 2020
CRAは医療機関に訪問をして、治験が決められた手順に従ってしっかりと実施されているかを確認していきます。
そして、CRCさんや医師に確認が必要な個所には付箋をペタペタと貼っていくのはよく見られる現場の光景です(笑
付箋をペタペタした後には、「CRCさん、ちょっと良いですか?ここって●●ですかね?」という会話や「先生、ここにこう書いてあるのですが、これは●●ということでしょうか?」という会話が繰り広げられるのでしょうね。
初回IRB pic.twitter.com/un33ewyKuE
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 23, 2020
IRB(Institutional Review Board:治験審査委員会)というのは、治験をその医療機関で実施しても良いか、被験者さんの安全性やその他倫理面で問題無いか等を審査する委員会のことです。
その中でも特に「治験を開始しても良いか?」という議題を審議する時のことを「初回IRB」と言います。
多数の治験審査委員会の委員に対して、治験の説明をし、委員会からの質問に回答をしていきます(説明は治験責任医師がする場合もありますが、CRAがする場合もあります)。
真ん中の3人は、治験審査委員会で質疑応答に対応している様子でしょうか。
実際には、これ程人数は多くはありませんが、圧迫感についてはこのくらいのイメージかもれしれません。
CRAで初回IRB未経験の方がいらっしゃったら…頑張ってくださいね…!(深くは語らない…笑)
え?こんなに返却?服薬コンプライアンス悪っっ😱 pic.twitter.com/cEi6OG2vt3
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 23, 2020
治験では、「治験薬の服薬率」についてもデータを取っています。
治験の服薬率が悪いと、正確に治験薬の有効性や安全性が判定できないために、「服薬率80%以上」など、規定を設けている治験もあります。
このシチュエーションは、治験薬の返却を受けたCRCさん、治験薬の返却状況を確認するために見たCRA、どちらにも言える状況なのかもしれませんね。
いずれにせよ、服薬率が悪いということは、治験では良くないことなので、医師から被験者さんに指導してもらう等対策が必要となってくるでしょう。
皆さん盛り上がっているので私も🙃
面会が17時からのはずが、先生が気まぐれで15時に『今良いよ!』。
CRCさんは慌てる私に一言『40秒で支度しな!』
CRAは、いつでも出陣できる準備を!#ジブリで学ぶ臨床開発 pic.twitter.com/8PdxIAXDs4
— のりす (@Chikennochikara) September 23, 2020
私も投稿をしてみました!
医療機関に訪問をした時には、医師に確認事項がある場合にはアポイントを取得します。
アポイントが17時~だった場合は、それまで医療機関内で治験に関する資料を確認しているのですが、先生の気まぐれでいきなりお呼びがかかることも。
そんなときには、CRAもCRCさんも慌ただしく急いで準備をします。
CRAの心得として、いきなり気まぐれで先生が現れても良いように、なんとなくでも聞くことをまとめながらお仕事をすることも大事なのかもしれません。
Enrollment completion!!#ジブリで学ぶ臨床開発 pic.twitter.com/VzN4MfEBCG
— April (@April15593169) September 23, 2020
目標症例数達成ということですね!
目標症例数が達成されたときは、先生もCRCさんもCRAも製薬メーカーの人もみんなにとって喜ばしいことですよね!
まさにこの画像のようにみんなで歓喜してお祝いでもしたい気分になります!
通院歴20年…ですか…#ジブリで学ぶ臨床開発 pic.twitter.com/mkj2O4399i
— April (@April15593169) September 23, 2020
治験では、参加された被験者さんに治験薬を投与しても良いかの適格性確認を行います。
適格性確認を行う時には、過去の治療歴などを見ることもあり、過去カルテがどのくらいあるかは、CRAそしてCRCさんにとって業務量に大きく影響してきます。
通院歴が短いと過去のカルテが少なく、チェックしなければいけない個所が少ないので「ラッキー!」となりますが、通院歴20年となると…
20年分のカルテの確認お疲れ様です!!(笑
来月からモニターが交代となります。
大変お世話になりました。#ジブリで学ぶ臨床開発 pic.twitter.com/Il5ydrEynb— Lisphilar (@lisphilar) September 23, 2020
モニター(CRA)が交代になるときには、しっかりこのように先生にもCRCさんにも挨拶をしておく必要がありますよね!
稀に、担当交代について先生に挨拶をせずに済ませてしまいトラブルになっていることもあるので、挨拶はやはりしっかりとやっておいた方が良いかと思います。
担当した瞬間からマイナスイメージなんて最悪ですからね!
多くの実りあるご指導をくださるKOLを座長にお迎えした症例検討会へ向かうスタディチームの面々#ジブリで学ぶ臨床開発 pic.twitter.com/Y2xMNPTOwk
— April (@April15593169) September 23, 2020
治験では、色々な状況の被験者さんのデータが集まります。
そのデータをどのように取り扱うかについては、症例検討会という会議で決められることになり、判断には医学的見解が必要になることもしばしばであるため、医師を含み症例検討会が開催されます。
KOL(Key Opinion Leader)は影響力の強い医師のことで、その分野の権威の先生であることから意見を頂く際には製薬メーカーのメンバーの多くが聴講しに伺うこともあります。
グローバルの会議で日本だけPIアポイント取得に1ヶ月かかっていることを詰められるローカルリード#ジブリで学ぶ臨床開発 pic.twitter.com/Xwjqm1p1PJ
— April (@April15593169) September 23, 2020
外資系製薬メーカーではよく見られるようなシチュエーションではないでしょうか。
グローバルと比較すると日本だけ出遅れてしまうこともあり、「なぜそんなに遅いの?」という質問をされることもしばしば。
その度にローカルリードは一生懸命説明をする訳ですが、グローバルからは「理解できない」と言われてしまうことも。
日本の体制にはまだまだ改善する余地がありそうですね。
この書式5だけは汚せない、契約が遅れるの#ジブリで学ぶ臨床開発 #電子でやり取りしようよ pic.twitter.com/iJUUhFjtDy
— ディーツー 🇮🇪ダブリン在住 (@kawauso_ch) September 23, 2020
治験審査委員会で承認を受けてから医療機関と契約を締結して初めてその医療機関で治験が実施できます。
書式5というのは、治験審査委員会での審議の結果が記載された書類のことで、そこで「承認」となっているのを確認して急いで契約の手続きをしていきます。
この時期のCRAは忙殺されており、「契約が遅れてしまうこと=治験の開始時期が遅れてしまう」ので、とにかく必死で対応をしています。
万が一、書式5の発行が遅れてしまった場合には、やはり契約が遅れてしまうため、なんとしてでも守り切りたいという思いが伝わってきます。
被験者登録期間終了が迫ってきた時期の依頼者からの電話#ジブリで学ぶ臨床開発 pic.twitter.com/yYaHheALGW
— 平凡おにーる (@YWy2QXHV4xXRRNQ) September 24, 2020
被験者登録機関の終了が迫ると、「おい、大丈夫か?契約症例数まだ満了していないけどちゃんと満了できるか?」というプレッシャーが依頼者(メーカー)からCROなどにかけられることがあります。
そして、CROのCRAからCRCさんにお問い合わせがいくこともあるでしょう。
”契約症例数の満了”は治験をおこなう上で、CRAやCRCさんの大きな目標の1つでもあるので、目標を達成するには日々どんなことをやったら良いのか(どのような対策を取ったら良いのか)をしっかりと考えていく必要がありそうです。
契約症例数を早期達成してしまえば、依頼者からの圧力もないですからね!
治験薬作用機序(拮抗薬)のプレゼン資料の図 pic.twitter.com/ZFi375ZuiO
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 24, 2020
治験を医療機関で始める際には、医療機関で説明会をしますが、そのときには治験薬の作用機序も説明することになります。
この画像はまさに拮抗薬の作用機序の図!!
物凄く詰まっているので、この治験薬は素晴らしい作用があることなのでしょう!
トラブル系
モニレポあと少しで完成のところで、パソコンフリーズ pic.twitter.com/jc2yVOqvgS
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 23, 2020
「目がー、目がー!」と目を覆いたくなる程の出来事が起きたようです。
CRAは、医療機関に訪問した際などにはモニタリング報告書(モニ報やモニレポと呼ばれています)を作成する必要があります。
その報告書を書いているところでパソコンがフリーズしてしまった場合、最悪最初から書き直しということもあり得ます…
軽い内容のものであればまだしも、比較的重い内容の場合もあるので、重い内容の時には目も当てられない状況になること必至です。
重い内容のときにはこまめに途中保存を!
ICありがとうございます!!
…っその先生っ…まだデリログ…取れてないッ…#ジブリで学ぶ臨床開発 pic.twitter.com/uwlpWncVku— April (@April15593169) September 23, 2020
まずは、IC(Informed Consent)とは、被験者さんからの同意取得のことになります。
被験者さんに治験の説明をして、治験に参加していただいたので、先生に御礼を言うCRAのシチュエーションですね。
ここまでは、喜ばしいことなのです、ここまでは…。
次にデリログ(Delegation Logのこと)ですが、これは役割分担表みたいなものです。
治験では、誰がどの役割を担っていて、どこまでのアクションをすることが出来るのかということを治験が始まる前に決めます(デリログが無い治験もあります)。
そして、このデリログは、任命+任命された人の署名が必要になってきます。
任命された人の署名が無ければデリログは完成しているとは言えず、そのような状況では治験行為をしてはいけないことになります。
それを知った時の表情はまさにこの画像の通りで、CRAとCRCさんは非常に焦った表情になることでしょう。
年末のSAEって、孤独、、#ジブリで学ぶ臨床開発 pic.twitter.com/y34K9IWfba
— ディーツー 🇮🇪ダブリン在住 (@kawauso_ch) September 23, 2020
SAE(Serious Adverse Event:重篤な有害事象)とは、凄く大雑把に簡単に表現をすると、被験者さんに生じたもので、至急、製薬メーカーに情報を伝達しなければいけないような出来事のことです。
CRAとCRCさんは至急の対応に追われる訳ですが、年末にSAEを引いてしまった場合は、他の方もいなく、社内で一人粛々と対応を進めなければいけないこともあります。
非常に孤独で悲しいことでしょう。
ちなみに私は、1月1日にSAEを引き、年始早々えらい目にあったことがあります…(他にも似たような方がいるのでは!?)
医療機関サイドの視点
では、続いて医療機関サイドからの視点でのツイートを見ていきましょう。
日常系
被験者さん呼ばれるの次かな…いや、次の次かな…#ジブリで学ぶ臨床開発 pic.twitter.com/W63tfeYAxr
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
CRCは、治験に参加している患者さん(被験者さん)が呼ばれた時には一緒に診察室に入ったりと色々な対応が発生します。
もちろん待合室には治験に参加している被験者さん以外にも多くの患者さんがいらっしゃるので、CRCさんはまだかまだかとそのタイミングを見計らうことになり、その描写を表現したものかと思います。
被験者さんを待っているであろうこの表情もなんとも言えない味を出していますね!
お煙草は…(current smokerか)
何歳位からお煙草吸われてますか?1日大体何本位?はいはい…#ジブリで学ぶ臨床開発 pic.twitter.com/3NfZjIiyZs— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
治験に参加することになる被験者さんは、治験に参加するための同意をした後にまず始めに治験に入ることが出来るかを確認されます(適格性確認と言います)。
治験によって確認される項目は色々違うのですが、多くの治験では「飲酒歴」や「喫煙歴」を確認することになっているので、このツイートはその喫煙歴を調べている描写のようですね。
この後、きっと飲酒歴などについても確認されることになるのでしょうね。
採血なかなか呼ばれませんねー。この時間は混んじゃいますね。お時間大丈夫ですか?#ジブリで学ぶ臨床開発 pic.twitter.com/kvA2sSBdmJ
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
治験では、被験者さんの来院日には採血があるというデザインが多いです。
治験以外の患者さんも多くいる待合室で、採血の順番を待つ被験者さんとCRCさんというシチュエーション。
「お時間大丈夫ですか?」というさり気ないことばをかけるCRCさんですが、こういった細かい気遣いも被験者さんの対応をするうえでは重要なのでしょうね。
先生、あと3分で検査開始でーす!技師さんもスタンバイお願いしまーす!#ジブリで学ぶ臨床開発 pic.twitter.com/PeEc5K9pgg
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
CRCさんは、医療機関内で治験が円滑に行われるように調整をする役割を担っています。
被験者さんの対応だけではなく、治験に関わる医師や臨床検査技師さんに対しても治験の手順がしっかりと守られるようにアクションを取る必要があるのです。
治験が円滑に行われるのはCRCさんの力によるところが大きいと言えるでしょう。
え、薬局で買ったサプリも報告しないといけないの? pic.twitter.com/sjZm3jytAz
— や え (@yaesan0518) September 23, 2020
治験では、「併用薬」として、治験中に服用のあった薬剤については治験のデータとして収集する対象になっています。
ただ、どの範囲まで集めるかは実は治験によって異なってくるのです。
医療用医薬品のみの情報を集めれば良い治験、薬局などで買えるベンザブロックなどOTC医薬品の情報も集める治験そして、サプリメントや医薬部外品の情報まで集める治験。
多くの場合は、サプリメントの情報までは求めないため、CRCさんとしては「え?そこまで必要な試験なの?」と感じることもあるでしょう。
プロトコールの中止基準にはこのように記載されてまして。#ジブリで学ぶ臨床開発 pic.twitter.com/ndrqbVZTgr
— 治験のおねいさん🥺💉 (@chiken_no_lady) September 23, 2020
これは、治験責任医師と治験分担医師に中止基準を説明するCRCさんでしょうか?
治験では、中止基準というものがあり、治験中にその基準に抵触してしまった場合には途中でその被験者さんの治験が中止となります。
CRCさんは、被験者さんがその中止基準に抵触していないかどうかについても日々確認をしており、場合によっては医師に確認をしてもらう必要があります。
確認をしてもらう時には、中止基準についてもCRCさんから医師に伝えたうえで、医師によって判断してもらわなければいけないため、その一場面の描写ということでしょうね!
明日SUMなんだけど…… pic.twitter.com/MrORFqqqrF
— や え (@yaesan0518) September 23, 2020
SUM(Start Up Meeting)とは、その医療機関で治験を始める際に治験に関係するスタッフ(治験責任医師、治験分担医師、薬剤部、検査科、事務課など…)を集めての治験の説明会になります。
基本的には、その医療機関を担当するCRAが医療機関のスタッフ向けに説明をすることが多く、CRAにとって最も緊張する仕事の1つと言えるでしょう。
SUMでは、治験の説明の後に医療機関のスタッフから質問が来て回答する必要があります。
CRAは治験自体に対する質問、CRCさんは医療機関内でどのように運用するのか等の質問に回答する必要があり、CRCさんにとっても非常に緊張するイベントの1つでもあります。
SUM前夜は質問にしっかりと答えられるように夜な夜な手順を見直すこともしばしば。
CRAもCRCさんも同じような状況ということですね。お互い頑張って乗り切りましょう…!
いいから!飲んで!いまここで!目の前で!飲んで!!!
(主にCNS)#ジブリで学ぶ臨床開発 pic.twitter.com/HuRE5xHZyi— April (@April15593169) September 23, 2020
必死に治験薬を飲んでくれとせがむ姿でしょうか。
CNS領域は、被験者さんの服薬率が悪い傾向にあり、先ほど少し触れましたが、服薬率が悪いと治験薬の有効性や安全性を正確に判定することが出来なくなってしまいます。
そのため、CRA、CRCさんともに被験者さんにはこのような気持ちになることでしょう。
CRA、CRCさんどちらにも当てはまりそうでしたが、現場で被験者さんを直接見ているCRCさんの方が抱く気持ちは大きそうなので、こちらに入れてみました。
えっ……………あ…………すいません………依頼者に確認、します…………(声がフェードアウト)#ジブリで学ぶ臨床開発 https://t.co/H3JAdEwi0Q pic.twitter.com/HyDDaOzrvi
— え ー (@eeeco_ms88) September 23, 2020
CRCさんは、被験者さんを直接見ている立場なので、被験者さんにかかる負担については特に真剣に考えています。
治験のデータを取る上では、採血を2回別々に取ることが正しいとしても、被験者さんの負担を考えると1回にまとめた方が良いこともあります。
この画像のシチュエーションは、CRCさんに詰め寄られているCRAということでしょう。言葉が詰まっているとこ辺りもリアルに表現されています。
この他のシチュエーションでも、「え?これ非効率じゃない?なんで?どうしてダメなの?」という質問をCRAは受けることもあります。
ここで1つCRAとして私は、「自分で考えておかしいと思ったら依頼者(製薬メーカー)に先に確認する」ということを心掛けていました。
経験が浅いCRAの場合はよくありがちですが、伝達係になるのではなく、自分でもしっかりとその内容を理解することが大切なので、心掛けていると良いかと思います。(それでも、うまくいかないことはありますけどね…)
次の来院日は朝から絶食ですからね!採血12時間前からはお水以外駄目ですよ!#ジブリで学ぶ臨床開発 pic.twitter.com/WPsyH46h2L
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
被験者さんに一生懸命説明をするCRCさん。
治験は手順に非常に厳しいので、もし忘れて次の日の来院日に朝食を食べてきてしまったら、別の日に再度、治験のために来院してもらう必要が出てきます。
有効性や安全性のデータをしっかりと正確に取るためには必要なことなのですが、被験者さんにとってもCRCさんにとっても誰も良い思いをしないので、被験者さんには是非覚えていてもらいたいですね!
対策として、前日にCRCさんが被験者さんに電話するなどがあるかと思います。
治験薬ボトル開きませんか?これチャイルドロックになっててーこうやって押しながら回すと…あれっ?開かなっ…あ、こうですこう!#ジブリで学ぶ臨床開発 pic.twitter.com/3mnNBBae0m
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
治験薬のボトル、特に海外からの輸入物は開け方にコツがあるものがあります。
このように少々扱い方が分かりにくい治験薬については、CRAは治験が始まる前に治験薬のサンプルを医療機関に持参して関係者に説明をすると良いでしょう。
意外な場所に落とし穴があったりもするので案外あなどれないかもしれません。
「これ絶対実薬でしょ!だって味するし!」
#ジブリで学ぶ臨床開発 pic.twitter.com/ent5ztxlJf— hawk (@haseyama616) September 23, 2020
治験では、実薬とプラセボで比較をおこなうデザインのものがあります。
プラセボは実薬と形や味などをなるべく似せるように作るのですが、やはり完璧には似せることが出来ません。
本気を出して色々試せばプラセボと見破れることもあるでしょう。
被験者さんがコナンごっこをしていたとしてもそこを華麗に受け流す能力もCRCさんには必要なのかもしれません。
PRT持った?ICFある?あとWSとアンケ調査類、割り付け用PCと検査キットとマニュアルと…ヨッシャ行くぞV1!!EDCマニュアルは今はいらないでしょ!#ジブリで学ぶ臨床開発 pic.twitter.com/uwztpmpDhB
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
これは、先輩CRCさんから後輩CRCさんへの確認ですかね?
被験者さんが来院される際には、CRCさんは万全の準備をしてその時を迎えます。
特殊なものを用意しなければいけないときは、トラブル回避のため、CRA側からもCRCさんに事前にリマインドを入れるのも良いかと思います。(最初だけでも)
また、この荷物の多さも良い味を出していますね…(笑
実は書いてるんですよ。この表5の欄外に小さくある注釈27の右側に…
#ジブリで学ぶ臨床開発 pic.twitter.com/toJQLHuH1h— hawk (@haseyama616) September 24, 2020
これは、CRAから説明を受けるCRCでしょうか?
治験では、治験実施計画書(プロトコール)や手順書に沿って対応をするのですが、時々注釈ですごーく小さくトラップじみた内容が書いてあることがあります。
説明を受けるCRCさんのこの後の反応は、「えー!?だって…、えー!?まあ、そうだけどさ…これじゃ分かりにくいよー!」とかなるのでしょうね。
依頼者(メーカー)は誰が見ても分かりやすいプロトコールを作ることを心掛けなければいけませんね!(頑張ります…!)
「こら千尋‼︎なんて顔してるんだいっ‼︎よりによって、一番見られたくないWSを監査官がじっくり見てるからって、そんな顔するんじゃないよ‼︎」#ジブリで学ぶ臨床開発 pic.twitter.com/B33KOivDKp
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 24, 2020
WSは、ワークシートのことですね。治験の情報を記載する用紙と思ってもらえれば良いです。
治験では、治験の品質を担保するために、治験を実施しているいくつかの医療機関に監査が入ります。
全く問題が無く自身満々であれば良いのですが、やはり監査官に突っ込まれたくないこともあったりします。
そんなときに、その該当資料を監査官がじっくりと見ていたら、CRCさんもこの千尋の表情になってしまうかもしれませんね。
今日も荷物多いですね。うちのSDV終わったら次の施設は遠方ですか?あー飛行機…大変だー…#ジブリで学ぶ臨床開発 pic.twitter.com/3q4ZgYyueO
— 駆け出しCRCうづき (@CRC93325171) September 24, 2020
CRAは、外勤が数日続くこともあります。
明日は、名古屋でSDV(Source Document Verification)をした後にセントレア空港に向かって、新千歳空港に行ってそこから札幌に移動して…など。
大きなスーツケースを持って移動することも多いCRAは、CRCさんからこのツイートのように話しかけられることもあるでしょう。
連続外勤のときは、なるべくお土産をCRCさんに買っていっていましたが、結構喜んでもらえたので余力があればおすすめですb
トラブル系
こうして原資料は紛失する#ジブリで学ぶ臨床開発 pic.twitter.com/IRSPIn3X75
— 治験のおねいさん🥺💉 (@chiken_no_lady) September 23, 2020
「原資料」というのは、ざっくり言うと治験のデータの根拠となる資料のことを指します。
患者さんの検査の結果であれば検査報告書、合併症などの情報であればカルテ、飲んでいるお薬の情報であればお薬手帳など…色々なパターンはあるのですが、とにかく治験においては”とても大切な資料”と思ってもらえれば良いです。
ということで、この原資料という資料を無くしてしまうことは大変なことなのです!
普段からの整理整頓…これは大切ですね。。
入力途中に呼び出されて戻ったらタイムアウトで保存されてなかった時#ジブリで学ぶ臨床開発 pic.twitter.com/cZj9Gmdy92
— 駆け出しCRCうづき (@CRC93325171) September 23, 2020
ムスカ様再びの登場。
治験のデータは、EDC(Electronic Data Capture)というシステムに入力をする必要があります。
EDCへのデータ入力は主にCRCさんのお仕事ですが、作業中に呼び出されてしまうこともあるようです。
そして、EDCは治験のデータが入力されているものなので、セキュリティ的に一定時間が経過すると自動的にログアウトする仕様になっているため、せっかく途中まで入力をしてもログアウトになってしまったらすべて入力をし直す羽目になります。
こちらもこまめに保存をすることが大事ですね!(途中で保存できないものもありますが…笑)
患者日誌……消えるペンで全部書かれてる…… pic.twitter.com/Ngl8R5vqLL
— や え (@yaesan0518) September 23, 2020
これは治験の業界にいないと分からない感覚かもしれません。
患者日誌は、被験者さんが治験で必要な情報を記載するための日誌になるのですが、これは先ほども少しお話した「原資料」のうちの1つになります。
治験関連の資料については、データ改ざん防止のため、鉛筆での記載や修正液・修正テープの使用(ここは特に注意!)そして、消えるボールペンの使用は適切ではありません。
CRCさんから被験者さんに説明はされているとは思いますが、やはり被験者さんがそのことを忘れてしまうこともありますよね。
万が一このようなことになったときの対処法もあるのですが、プロフェッショナル向けなので、ここでの記載は控えておきます。
とにかく、これは「あちゃー」というシチュエーションということですね。
先生!!!SAE起きたら連絡してって言ってるじゃないですか!!!!#ジブリで学ぶ臨床開発 pic.twitter.com/mzQ5V6pJad
— え ー (@eeeco_ms88) September 23, 2020
これは、メラメラと燃え上がるような殺気を醸し出したCRCさんでしょうか。
SAE(Serious Adverse Event:重篤な有害事象)とは、凄く大雑把に簡単に表現をすると、被験者さんに生じたもので、至急、製薬メーカーに情報を伝達しなければいけないような出来事のことです。
大体の治験では、「治験責任医師がSAEを知り得てから24時間以内に治験依頼者(製薬メーカー)に報告をすること」のような決まりがあるため、SAEが起きた際には、CRCさんもCRAも大慌てです。
SAEに該当するシチュエーションはいくつかあるのですが、そのうちの1つ「入院」が最も多く、被験者さんが入院をした場合には、24時間以内に対応が必要になります。
そのため、SAEに該当するシチュエーションが起きたら、まずCRCさんに情報が行くような仕組みなっていることが多いかと思います。
ただ、先生の中には「入院をしたら至急報告をしなければいけない」ということを忘れてCRCさんに連絡をしていないこともあり、そのことについてCRCさんが先生に殺気立っているものと思われます。
それにしても…凄い威圧感ですね(笑
どぅっわぁああああああ、文字間違えたぁあああああ‼︎‼︎!誤記訂正する余白がないぃぃ… #ジブリで学ぶ臨床開発 pic.twitter.com/P6qMqLa7YB
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 24, 2020
ムスカ大佐大人気!
治験では、ワークシートといって、治験の情報を記載する用紙を使うこともあります。
誤記があった場合には、単純に二重線を引いて直せば良いわけではなく、修正した人、修正日や修正理由を記載する必要があります。
これが1回だけならまだしも、何回かやってしまうとこのツイートのようにそれを記載する余白が無くなってしまい泣いてしまうこともあります。。
余白には注意が必要ですね…!
豆知識
君たちは知らないと思うけど、かつては治験届もCSRも定規で線を引いて作っていたんですよ。#ジブリで学ぶ臨床開発 pic.twitter.com/x9p8fjj8xI
— April (@April15593169) September 22, 2020
こちらは、April (@April15593169)さんによる作品で、今回の「#ジブリで学ぶ臨床開発」の発端となったツイートです。
治験では、治験届やCSR(Clinical Study Report:治験総括報告書)など様々な資料が発生するのですが、今やそのほぼ全てがPC使って作成されています。
線を引くのもExcelやWordであれば綺麗なものが一瞬で引ける良い時代になりましたが、かつては定規で線を引いて作っていたということで驚き。
精度について、どうなんでしょうね…?
あとは、修正が入ったときはまた作り直しなのでしょうか…昔の方はすごい…!
資料組みってね、実は並べて取るよりこうやってトランプ配るみたいにすると正確にできるよ。1枚足りなーいって番町皿屋敷になりにくいよ。#ジブリで学ぶ臨床開発 pic.twitter.com/onOxvCSTev
— 駆け出しCRCうづき (@CRC93325171) September 24, 2020
資料を組む時の豆知識が紹介されています!
これはCRCさんのみならずCRAでも使えますよね!
特に初回IRBの資料を組むときには大量の資料をファイリングする必要があるので、このような手順でまとめていくと良いことでしょう。(それでも、時々「1枚足りない!!どこ!?」となることがありますが…笑)
まとめ
今回は、9月24日までの「#ジブリで学ぶ臨床開発」をまとめていきました。
投稿のほとんどは、CRAやCRCさんによるもので、実際に現場で起きていることを取り上げた話題が多く、どれも非常に頷けるものばかりでした。
昨今はコロナ禍の影響もあり、現場での経験がなかなか積めないというCRAやCRCさんもいらっしゃるかと思います。
ここに登場した内容は現場での状況をリアルに表現したものばかりですので、少しでもその空気感を味わって貰えたら嬉しいです。
「#ジブリで学ぶ臨床開発」シリーズ第2弾も御座いますので、よろしければそちらもご覧下さいね!
前回の『「#ジブリで学ぶ臨床開発」をまとめてみた~第1弾~』に引き続き今回は第2弾となります。 臨床開発の現場で実際に働いている方々によるリアルで微笑ましく特にシリアスな作品で溢れ前回は大きな反響がありました。 今回も素晴らしい作品が勢ぞろいです! 臨床開発の業界で働く人、これから臨床開発の業界を目指す人、全然治験のことは知らないけどなんとなく興味がある人、色々な方にお楽しみいただけるよう今回も1つ1つしっかりと解説をしていきたいと思います








“「#ジブリで学ぶ臨床開発」をまとめてみた~第1弾~” への6件のフィードバック