
リスクに基づくモニタリング(Risk-Based Monitoring:RBM)という考え方は、2011年8月にFDAとEMAにより相次ぎ発表されたガイダンス案が始まりでした。
その後、2013年には日本でも「リスクに基づくモニタリングに関する基本的な考え方について」が発出され、2015年にはICH-E6 Step2ガイドラインに掲載されました。
今までもよりも適切で効率的なモニタリング手法として考案されたRBMですが、昨今のCOVID-19の蔓延もあり、再度注目が高まってきています。
今回はそんなRBMについて、基礎的なところからお話していきたいと思います。(意外に単純なので、就活生や経験が浅い方も理解できると思いますよ!)
リスクに基づくモニタリング(RBM)の考え方が生まれた背景
RBMは、より効率的なモニタリングを実施するために考案された手法です。
今までのモニタリングは、色々と効率が悪いと考えられるようになり、このRBMの考え方が普及してきた訳ですが、まずは今までのモニタリングについて見ていくことにします。
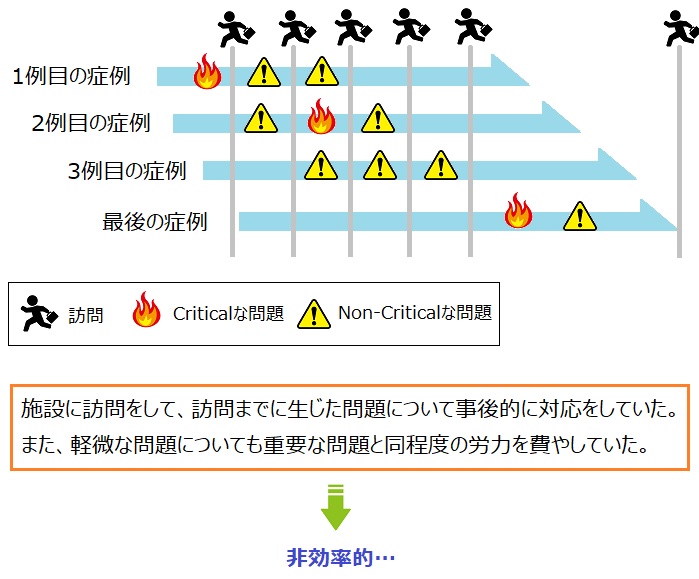
今までのモニタリングは、治験の実施医療機関(以下、「施設」と呼びます)で治験が適切に行われているかどうかは、CRAが実際に施設に訪問をして確認することをメインとしていました。
施設に訪問をしたCRAは、問題が発生していないかを確認して、もし何らかの問題が発生していた場合には、その問題に対して是正措置(問題が起きていたら、それを解決させること)を行い対応していたということですね。
これがいわゆる出口管理と呼ばれる方法になります。
しかし、このやり方を今までずっとやってきたのですが、ある時、気付いてしまったのです。
「モニタリングに凄いコストをかけているけど、当局からの重大な指摘はやっぱりされるし、コスパ悪くない?」と…
そこで、何がいけないのかを考えたわけです。
従来のやり方をもう1度見てみましょう。
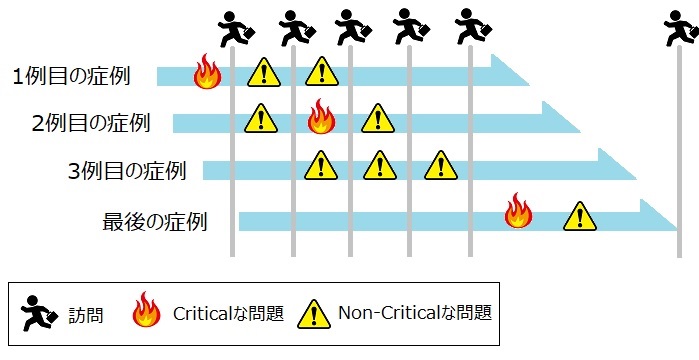
この方法では、問題が起きてからCRAが問題に対処をしていますよね。それに少々、問題が多く発生しており、対処しなければいけない事項が多くあります。
ここで、考えてみてください、「もしこの問題がそもそも発生しなかったら」と。
そうすると、こんな感じになります。
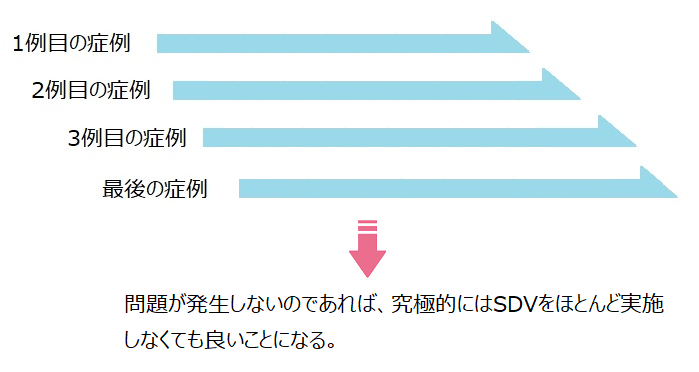
でも、実際には、事前にリスクを抽出したとしてもCriticalな問題を全てピックアップ出来る訳では無いので、現実的には以下のような感じになります。
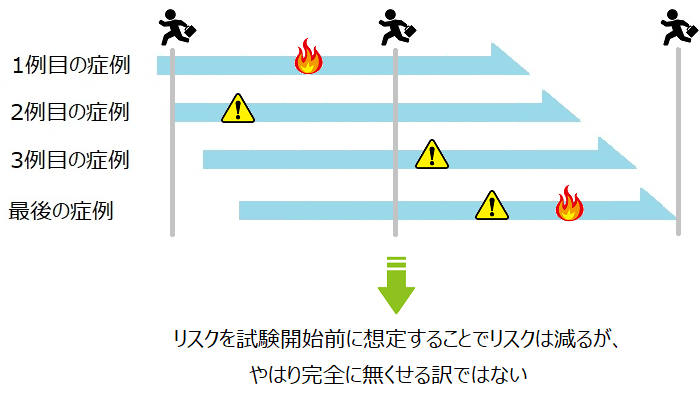
ここで着目するポイントは、Criticalな問題とNon-Criticalな問題があるということ。
治験では、このCriticalな問題をしっかり見つけて対処していく必要があります。
ちなみに、モニタリングをやったことがない方もこの記事を見ているかと思うので、Criticalな問題とNon-Criticalな問題についてだけ簡単に説明しておきましょう。
Criticalな問題
被験者さんの安全性に影響を及ぼしたり、有効性などの治験のデータの質に影響を及ぼすようなものです。
そして、それによって、承認の意思決定や治験を中止するという意思決定など、重要な意思決定に影響を及ぼすような問題のことを指します。
例えば、ある治験の主要評価項目(治験の有効性を確認する際の最も重要な指標)が、「治験薬服用前から治験薬服用終了後の血圧の変化率」だったとします。
その場合、言うまでもなく血圧の測定値は非常に重要なデータとなる訳ですが、血圧の測定方法などを記載した手順書のやり方を完全に勘違いしていて、正確に測定出来ないような方法で継続的に測定されているような状況もCriticalな問題に該当します。
このような問題は、しっかりと検出をして再発をしないよう、予防策を講じていく必要があります。
Non-Criticalな問題
その問題によって、被験者さんの安全性に影響を及ぼしたり、有効性などの治験のデータとしての質に影響を及ぼさないようなものです。
例えば、本来カルテから治験用にデータを収集するためにEDCに入力しなければいけない項目の入力が漏れてしまっているが、それによって治験全体の結果に大きな影響を及ぼすようなものではないものを指します。
もちろん、本来はしっかりとEDCに入力されなければいけないものであるため、問題は問題なのですが、Criticalではなく、Non-Criticalな問題となります。
つまり、RBMの考え方は以下のようなイメージを持ってもらえれば良いかと思います。
①そもそも問題が発生しないように予め想定されるリスクを洗い出して、問題が起きないようなプロセスを構築しよう。
②そうすれば、問題がそもそも発生しないはずだから、訪問頻度が低くても質は落ちないでしょ。
③当然、訪問頻度が減れば、CRAもCRCも負担が軽くなるし、なんならコストも削減できるでしょ。
④でも、まぁ、問題が起きることもあるだろうからその時は次に同じようなことが起きないように対処しよう。
⑤あ、ちなみに、軽微な問題とかはいちいち過敏に反応しなくて良いから、Criticalな問題をしっかり考えれば良いから。本質を見ようよ!
大まかな流れはこんな感じです。
もちろん、細かくは色々あるのですが、ここでは大枠を掴んでもらえれば良いと思うので、このくらいで良いです。(簡単ですよね?)
上記のように、CRAの訪問頻度が減ると、コストの削減以外にも、そのリソースを医薬品開発フローの他のセクションに再配置することで、そのセクションの業務効率も向上し、結果として医薬品開発全体の迅速化に繋がることも期待されます。
RBMではリスクの特定・評価と定期的な監視が重要である
RBMを運用していくうえで最も重要なのは、リスクの特定・評価を行うことと定期的なリスクの監視をしていくことです。
この2点をしっかりと行うことが、RBMを運用する上での大前提となりますので、RBMを理解する上でここは外せません。
では、具体的にどのような手順でリスクの特定とリスクの評価を行っているかを見ていきましょう。
リスクの特定・評価
リスクの特定は、試験開始時点で行っていきます。
予め、その試験で発生しそうなリスクについて、「発生頻度(Probability)」、「影響度(Impact)」、「検出性(Detectability)」などを考慮してリスクレベルを設定していきます。
それぞれ、High=3、Medium=2、Low=1というようにスコアリングをしてリスクレベルを設定していくことが一般的ですが、少し具体的に見ていきましょう。
主要評価項目:拡張期血圧
治験の特徴:この治験は、家で患者さんが血圧計を操作して血圧を測定する必要がある。
想定されるリスク:患者さんが血圧計の操作方法を誤り血圧が正常に測定できない可能性がある。
リスクレベル評価:発生頻度 3点 × 影響度 3点 × 検出性2点=18点
被験者さんが操作するので、誤って操作してしまう頻度は比較的高い(3点)と想定でき、主要評価項目が拡張期血圧なので、誤ったデータが及ぼす影響度は高い(3点)と思われる。また、データを見ただけでは誤った測定かどうかは分からないのものの、被験者さんに聞き取りをしたり、明らかにおかしい数値が出ていたら気が付くことが出来る(2点)。
この点数については、誰か1人で決めるのではなく、CRAやDMや統計解析担当者など、色々な立場の人が集まり部門横断的に評価することができ、適切であると考えられています。
このように想定できるリスクを1つ1つ洗い出し、事前に評価することで、必要な項目については、そのリスクが生じないよう対策を事前に講じていくことになります。
リスクの特定には、必ずこの方法をやらなければいけないという決まりは無いものの、大手グローバル製薬企業が共同で設立したNPO法人であるTransCelerate Biopharmaから提案されたRACT(Risk Assessment and Categorization Tool)を参考にしている製薬メーカーやCROが多い印象です(先ほど例を示したものもRACTを参考にしています)。
そこから、各社のノウハウを反映させ、RACTをカスタマイズしたテンプレートを使用している企業もあります。(CROのA2ヘルスケアなどはRBMのパイオニアを目指していることもあり、独自のテンプレートで差別化を図っていますよね!)
リスクについては、上記のようにプロトコルによるリスクの他に医療機関毎にもリスク評価がされ、そのリスクスコアに応じて、施設訪問頻度を決めていく流れになります。
定期的な監視
試験の開始時点でしっかりとリスクを洗い出して対策をしておけばそれで良いかというとそうもいきません。
試験が始まってからは、医療機関のリスクスコアが適切であるかの判断や、想定外のリスクが生じていないかの確認を定期的に実施していく必要があります。
その定期的な確認方法として出てくるのが、中央モニタリング(Central Monitoring)とリモートモニタリング(Remote Monitoring)等になります。
中央モニタリングとリモートモニタリングの役割

定期的にリスクを評価していく方法として、中央モニタリングとリモートモニタリングについてお話に出しましたが、その2つのモニタリング手法について簡単に紹介をしていきます。
中央モニタリング(Central Monitoring)
中央モニタリングは、インハウス(会社内)で確認出来るような、EDCに入力されたデータやIWRSなどのWeb登録センターシステム等に入力されたデータを出力して、施設横断的に確認する方法です。
施設毎にモニタリングをした方が良い項目もあるのですが、逆に全施設共通のことに関しては、施設毎ではなく施設横断的に確認をした方が問題を察知できることもあります。
実例を挙げてお話をしていきましょう。
例えば、治験では、治験で得たデータをカルテなどの原資料からEDCに転記するアクションが発生します。
ここで、EDC入力までの期限を「被験者が来院してから1週間以内」と規定していたとします。
中央モニタリングを行う際に、被験者の来院~EDC入力までの期間をA施設~E施設の5施設で出したところ、以下のような結果となりました。
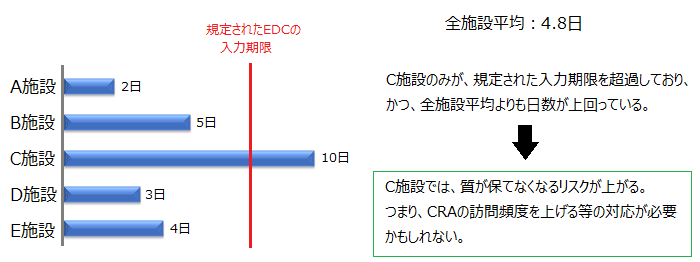
このように施設横断的に見てみると、Cは全施設の平均よりもEDC入力までに時間がかかっており、更に被験者が来院してから1週間以内の入力というルールも守れていないことが分かります。
このデータだけでは判断は出来ませんが、施設Cについては、他の施設と比較するとリスクが高い可能性(他にも規定が守れていない可能性)があると考えられ、医療機関への訪問頻度を見直す必要も出てくるかもしれません。
他にも、例えば、有害事象の入力数が極端に多かったり、逆に極端に少ないような施設があった場合には、有害事象の評価が適切に実施されていないリスクも高まるため、評価を見直す必要が出てくる可能性があります。
上記のように、一言で言えば、全体のデータからの外れ値を検出して適切なリスク指標や閾値を設定する手法が中央モニタリングになります。
リモートモニタリング(Remote Monitoring)
リモートモニタリングは、施設のシステムやEDC、IWRSなどのシステムにアクセスをして実施するオフサイトモニタリングのことを指します。
基本的には、中央モニタリングによって検出された問題に対応するために実施される手法ですが、医療機関のカルテに外部からアクセス出来るなど、原資料(原データ)に直接アクセスできる場合には、SDVを実施することも可能です。
RBMの導入はCRAの今後にどう影響していくのか?
RBMに限った話ではないのですが、医薬品開発の迅速化に向かう過程でCRAが施設に訪問する頻度は今後更に減っていくことが予想されます。
しかし、その分、施設訪問の重要性が今まで以上に高くなり、CRAに求められるコミュニケーション能力もより高水準となっていくものと思われます。
Twitterでも少しお話に出したことがある私見ですが、“できるCRA”の1つの要素として、”気が利くCRA“、つまり、想定されるリスクを先回りして予測して、施設側に注意喚起をしたり、配慮することができるCRAだと思っています。
まさにRBMでは、リスクの先回りの想定が重要になってきますので、今までの“できるCRA”がもしかしたら今後は、それが普通と思われる時代が来るのかなと思っています。
まとめ
ざっくりではありましたが、今回はRBMについてお話をしていきました。
品質管理・品質マネジメントは、従来のモニタリングで行われていた出口管理の時代からICH-E6(R2)によりプロセス管理の時代に入り、今後近いうち(2023年頃?)に訪れるGCP Renovationでは、プロセス管理より更に上流のQuality By Design(計画に基づいた質の確保)の導入が始まります。
時代の流れは、医薬品開発の品質向上と迅速化を達成できるような仕組み作りに向かっており、Risk-based Monitoringの理解は必要不可欠になってきますので、是非このブログを取っ掛かりとして深く理解していただければ幸いです(私も頑張って勉強します!)。







“治験でのRBMとはどんなもの?基礎やメリットを分かりやすく解説をしてみる” への4件のフィードバック