
前回の『「#ジブリで学ぶ臨床開発」をまとめてみた~第1弾~』に引き続き今回は第2弾となります。
臨床開発の現場で実際に働いている方々によるリアルで微笑ましく特にシリアスな作品で溢れ前回は大きな反響がありました。
今回も素晴らしい作品が勢ぞろいです!
臨床開発の業界で働く人、これから臨床開発の業界を目指す人、全然治験のことは知らないけどなんとなく興味がある人、色々な方にお楽しみいただけるよう今回も1つ1つしっかりと解説をしていきたいと思います。
今回の記事について
前回は、9月24日までに投稿された記事をピックアップしていきましたが、今回は9月25日から現在記事を書いている10月9日までに投稿された作品を紹介していきます。
今回も、もちろん業界の方以外が見ても分かるようにしっかりと解説を加えていきますが、第1弾の記事から見ていただくとより楽しめるかと思います。
第1弾の記事をまだ読んでいない方は以下の記事からどうぞ!
2020年9月18日にスタジオジブリ作品の場面写真が公開されました。 「常識の範囲内でご自由にお使いください。」とのことで、Twitterでも「#ジブリで学ぶ~」シリーズが色々と発信され、かなり盛り上がりを見せています。 そこで、今回は、「#ジブリで学ぶ臨床開発」について、まとめてみました。 これから臨床開発のお仕事を目指す就活生など治験のことをあまり知らない方にも分かるように簡単な説明を加えながらご紹介をしていきますので是非ご覧下さい!
メーカーサイドの視点
では、前回と同じようにメーカーサイドの視点の作品から見ていきましょう。
日常系とトラブル系でまとめていきます。
日常系
エ~~ット明日はA施設のIRB発送〆切だから書式10と書式16と院内見解様式、来週B施設の〆切だからこの書式11は明後日の面会時にPIのハンコもらって、進捗表ぽちぽち…と、よしOK、じゃあモニ報書いて、あと月曜はC施設のSDVだからデータ確認し…えっ別の試験で期間延長?#ジブリで学ぶ臨床開発 pic.twitter.com/cTzH67F5oE
— April (@April15593169) September 25, 2020
この作品からは、担当している医療機関で色々な手続きが一斉に発生しててんやわんやしている様子が伺えますね!
治験を実施するには、色々な決まりごとがありそれらをしっかりと遵守して対応する必要があります。
この作品の主人公は、4つの医療機関(あるいはそれ以上?)を担当していて、それぞれで一気に対応しなければいけないことが降りかかってきてあたふたしたご様子といったところでしょうか。
このような状況になってしまうとCRAは一時的にかもしれませんが、多忙を極めることになります。
手続きが片付いて落ち着けば平穏な日々に戻ると思うので、少しの辛抱です…!
(二日酔いでSDV来ました…)
#ジブリで学ぶ臨床開発 pic.twitter.com/FDT5tFAKpF
— DskeM (@dske1124) September 26, 2020
カオナシの表情がまた何とも言えない空気を醸し出している作品です。
二日酔いでSDVに行ってしまうと、作業効率はもちろんのこと、お酒の匂いがプンプンしてしまう可能性もありクレームに繋がってしまう可能性があるので、良い子は前日のお酒はほどほどにしましょう!
やっぱ読めなーい pic.twitter.com/upPabuo4G8
— いくら@臨床開発モニター (@k023yrHnpkICAB8) September 26, 2020
最近では、電子カルテがかなり普及してきましたが、クリニック等では今でも紙カルテを使っている医療機関もあります。
CRAは、紙カルテの内容から治験が適切に実施されているかを確認するお仕事なので、紙カルテを読まなければいけない訳ですが、先生の字が汚すぎて読めないこともしばしば。
そんなときに、字が綺麗な先生の紙カルテに当たった時、CRAは内心でこのムスカ様のように感動を覚えることでしょう。(1枚目)
と思ったらやはり読めなかったようですね…!
世の中そう上手くはいかないとういうことでしょうか…
それでも、CRAはしっかりとカルテの内容を解読しなければいけません。こういう場合どうしたら…
(熟練CRC)スッ…これはnp、問題なしです。先生勢いで書いてるけどほら、この検査報告書にも同じ筆跡があるでしょう?#ジブリで学ぶ臨床開発 pic.twitter.com/yOKh7xJ6FP
— 駆け出しCRCうづき (@CRC93325171) September 26, 2020
と、ここで救世主の登場のようです。
熟練CRCさんになると、先生の文字を解読出来ることも!とても頼れる存在ですね!
このような感じで、CRAはCRCさんに助けられる場面も多くあるので、普段からのコミュニケーションは大切にしておきましょう。
ちなみに、熟練CRCさんでも分からない場合は看護師さんに聞いてもらうことも…
この記事を読まれている方で看護師さんの方もいらっしゃると思いますが、紙カルテのことで聞かれた場合には是非ご協力をお願いします…!
「点検要綱案を作成したのですが、これ全部ロジカルチェックでEDC実装したら予算オーバーです」
「仕方ない。これとこれとこのチェックはマニュアルチェック(目視点検)で」
#運用でカバー#ジブリで学ぶ臨床開発 pic.twitter.com/r3QzLvgvdM— Natee (@chi_natee) September 26, 2020
治験のデータを収集するために使うEDCというシステムですが、入力されたデータに対して条件を組み込み、システム的に入力エラーを抽出することが出来ます。
そのことをロジカルチェックと言うのですが、システムを組むのには当然費用がかかります。
そんな時には、致し方なくデータマネージメントという職種の方に頑張って気合を入れて人力でエラーを発見してもらうことになり、それをマニュアルチェックと言います。
予算が潤沢にあれば機械的にエラーを抽出する方が確実なのでそうしたいところですが、そこは予算との相談ということになるのですよね。。
SDVしに来たが、原資料が全く作成されていなかった時の私#ジブリで学ぶCRA#ジブリで学ぶ臨床開発#ジブリで学ぶ治験 pic.twitter.com/1p80vztNZA
— 消滅 (@take18283) September 26, 2020
SDVというのは、Source Document Verificationの略で治験のために収集されたデータが医療機関で記録されているもの(原資料)と整合しているかを確認する作業で、CRAのメインのお仕事になります。
次に、原資料というのは第1弾のときにも出てきましたが、治験のデータの根拠資料のことです。
つまり、原資料が作成されていない状況では、当然SDVをすることも出来ないため、CRAにとっては激オコ状態ということになります。
CRAは遠方の医療機関を担当することもあり、遠方まで出向いたにも関わらず何も作業が進まない状態だと確かに厳しいところ…
もし怪しい担当施設があった場合には、訪問の数日前に「資料の整備は大丈夫ですよね?」という趣旨の連絡をリマインドで入れておいた方が良いこともあります。
スルーされる可能性も大ですが、何より対策をしっかりと取っておくことが大切なのです。
希少疾患の試験の立ち上げで連日徹夜でボロボロのときに担当施設のMRさんに「ただでさえ少ない症例を治験に取られるんですから、ハズレ引かされたなと思ってます」って言われたときの私#ジブリで学ぶ臨床開発 pic.twitter.com/VlSM6MtfmI
— April (@April15593169) September 26, 2020
これは満身創痍のCRAにとってはダメージを負う一言…!
ほとんどの治験では、禁止事項の1つに「同種同効薬の使用は禁止」という項目が入っています。
その他、治験に入ると安全性のことも考え色々な制限が発生します。
そうなってくると、MRさんにとっても影響が出てくるので、堪らずこの発言をされたのでしょう。(冗談の可能性もありますが)
電磁化(電子データ化)すれば楽なのに。#ジブリで学ぶ臨床開発 pic.twitter.com/cVRzh4rFzn
— Lisphilar (@lisphilar) September 28, 2020
電磁化をしないと紙の資料が溢れることになり、資料を紛失してしまうリスクも上がります。
最近では徐々に電磁化が進んできましたが、契約書などについてはまだ押印が必要な医療機関やメーカーも多く、完全に電磁化されるまでには少し時間がかかりそうです。
ただ、少しずつではありますが、着実に前には進んでいるため、10年後にはもしかしたら完全電磁化が達成されているかもしれませんね…!
選定調査後
CRA①:先輩、候補症例いそうですか?
CRA②:ふむふむ。いない。
#ジブリで学ぶ臨床開発 pic.twitter.com/PBOfUV58IH
— ふくふく (@CRA131nfgt) September 29, 2020
治験では、まず一番始めにどこの医療機関で治験を実施するのかを決めなければいけません。
そして、医療機関であればどこでも良い訳ではなく、色々な基準をクリアしなければいけないのです。
この”どこの医療機関で治験をやるのかの調査”のことを選定調査と言います。
そして、この選定調査は、CRAが医療機関に訪問をし、ヒアリングをしながら要件を確認していくケースが多いのですが、この作品はその選定調査後のCRAとその先輩の会話の場面でしょうか。
選定調査をした医療機関では、どうやら候補症例がいないということでしたので…場合によってはこの医療機関では治験はやらないという判断になる可能性があります。
「新人くん、先生の言ったとおりの症例数を持って帰ってきちゃだめよ?ちゃんと客観的に確認するのよ?」 #ジブリで学ぶ臨床開発 pic.twitter.com/8p9bp6I7EM
— るな@株と医療ニュースメモ (@Luna11053) September 29, 2020
選定調査では、医療機関でどれくらいの患者さんを治験に入れることが出来るのかの調査をしていきます。
そして、CRAは医療機関に訪問をし、先生と面会をしながらどれくらいの症例が組み入れられるのかの話を詰めてくるわけですが…
1つ注意しなければいけないことがあります。
それが、このるなさんの作品で先輩が言っている”先生の言ったとおりの症例数を持って帰ってこない”ということです。
後からCRCさんの作品でも出てきますが、やはり先生からしたら自分の医療機関で治験をやりたいという思いと、時々楽観視しており、「あー、うちなら●例くらい余裕だよ!!」と意気揚々に回答をしてきます。
そして、大体の場合、そんなに多くの症例が入らないことが多いのです…
先生のお話を聞きつつ、CRAが正しい方向に導きながら正確な見込み症例数を模索していかなければいけないので、ここはCRAの腕の見せ所ということですね!
さっすがですね!
同意見込みも確認してほしいですよね。
むしろこのプロトコルでどれくらいの同意取得率になりそうか意見が欲しいくらい。他の先生の担当患者や非常勤先から引っ張ってこれる分も加味してほしいところ。
— るな@株と医療ニュースメモ (@Luna11053) September 29, 2020
先ほどのるなさんの作品の発展バージョンですね。
その医療機関で組み入れられる症例数を導き出すには、「全体で対象疾患を持った患者がどれだけいるか→・・・→そのうちどれだけ同意が取れて治験に入ることが出来るか」など絞り込みをしていく必要があります。
やはり、その絞り込みにはCRAがうまく誘導をしながら正確な数を導き出していく必要があります。
そして、忘れてはいけないのが、こちらの作品でも触れている事務局の「達成率」の考え方です。
医療機関によっては、「契約症例数満了」ということにこだわるところもあり、その場合は、契約症例数を始めから大きく取るのではなく、しっかりと満了できる症例数で刻んでいかなければいけないこともあります。
CRAは、先生との打ち合わせだけで契約症例数を決めるのは危険で、しっかりと治験事務局の意向も聞いたうえで最終的な契約症例数を決める必要が出てくるわけです。
それにしても先輩CRA…すごく仕事ができるオーラ出してますね!
デバイスを馬鹿にしてるやつらは治験も指針も特臨もPMSもデータ申請もできるわけ?#ジブリで学ぶ臨床開発 pic.twitter.com/DsNNvch7pP
— April (@April15593169) September 29, 2020
「臨床開発」や「治験」というと、どうしても医薬品が注目されがちですが、実はそれらの言葉は医療機器(デバイス)に対しても使います。
一部の医療機器の上市には、治験が必要で医療機器もしっかりとしたルールに則って対応されています。
治験では医薬品の割合がかなり占めているせいか、医療機器について軽視されてしまうことがありますが、この作品からは医療機器の治験に携わるプロとしてのプライドが伺えますね!
SDVでは、他社の悪口をひたすら傾聴しておりました。
#ジブリで学ぶ臨床開発 pic.twitter.com/EUHv4FNXEv
— DskeM (@dske1124) September 29, 2020
CRAは医療機関に訪問をして、お仕事をするわけですが、医療機関によってはCRCさんと同じ部屋でお仕事をすることもよくあります。
CRAは必至にお仕事を淡々とこなしていくのですが、聞こえて来るのですよ、あれが。
CRCさんの雑談が。
雑談の内容は色々ですが、他社CRAの噂話もしばしばしており、CRAとしてはついつい気になってしまうのも実情。
私も噂されていたと思うと…う、世の中には知らない方が良いこともあるのです!笑
合意訪問後
CRA①:先輩、契約症例何例になったんですか?
CRA②:ふむふむ。3例。選定の時は強気に5例て言ってたのに。
CRA①:少ないっすね!
#ジブリで学ぶ臨床開発 pic.twitter.com/GknPcqiJ15
— ふくふく (@CRA131nfgt) September 30, 2020
先輩後輩シリーズ再びですね。
これも先ほどお話していた契約症例数のお話になります。
やはり、序盤は意気揚々と強気の症例数を言い放つ先生ですが、その後話を詰めていく段階や治験事務局の冷静なツッコミもあり、契約症例数が少なめになることも多くあります。
私が選定調査の際にCROに依頼することは”かなり厳しめに見積もってどれくらいか”ということです。
症例の見積もりは個人的にはやや厳しめくらいがちょうど良いと思っています。
SDVの予約取れた後
CRA:今度の福岡SDV、先輩も同行していただけますか?
先輩:しょうがない、、同行するよ
(もつ鍋食べたい)#ジブリで学ぶ臨床開発 pic.twitter.com/TjiOGM7ChA— ふくふく (@CRA131nfgt) October 1, 2020
可愛い?後輩からの同行依頼は先輩としては断れないもの。
と思いきや、案外ご当地グルメ目当てということも!?
出張はCRAの醍醐味!マイルも貯まりますからね、私は若かりし頃は出張大好きでしたよ!(今は体力が…笑)
CRCセントラルトレーニング後
CRA①:先輩の担当CRCさん可愛いかったですね〜
CRA②:ワシの帽子と髭もチャーミングじゃろ?
#ジブリで学ぶ臨床開発 pic.twitter.com/9MZa13I6ov
— ふくふく (@CRA131nfgt) October 5, 2020
担当のCRAがイケメンだとCRCさんがテンションが上がるのと同じく、担当のCRCさんが可愛いとCRAもテンションが上がるというもの。
リアルな会話が表現された作品ですね。
PIアポが夕方だったお陰で今日はドーミーインに後泊♨️ 大浴場は偉大なり#ジブリで学ぶ臨床開発 #臨床開発 #cra pic.twitter.com/1v4lT8lNIM
— ディーツー 🇮🇪ダブリン在住 (@kawauso_ch) October 6, 2020
ドーミインは私も大分お世話になっている、温泉付きのホテルになります。
大浴場でその日の疲れを取ってホテルのベッドにダイビングしたときの気分は最高です!
こちらの作品では、PI(Principal Investigator:治験責任医師)のアポイントが夕方で後泊OKな状況になったため、ホテルに泊まることが出来たようですね!
CRAは遠方であっても日帰りをしなければいけないこともよくあるので、ホテルでゆっくり休めるのはCRAにとっても至福のひとときですね。
文才のある看護師さんの看護記録は、仕事を忘れるくらい感情移入してしまうことがあるの#ジブリで学ぶ臨床開発 #臨床開発 #cra #臨床開発cra pic.twitter.com/vjCuGkqXRG
— ディーツー 🇮🇪ダブリン在住 (@kawauso_ch) October 6, 2020
CRAは、原資料として看護記録を閲覧することもあります。
看護記録には、看護師さんの文章が書いてありますが、時々感情移入するような文章が書かれている看護記録に出会うこともあります。
そんなときにはすーっと読み入ってしまうことも。
こちらの記事を読まれている中で看護師さんの方もいらっしゃると思いますが、実は治験で見られていることもあるのですよ!
トラブル系
「必須文書が、、保管されて、、、ない」#ジブリで学ぶCRA#ジブリで学ぶ臨床開発#ジブリで学ぶ治験 pic.twitter.com/HgxwmRWf5a
— 消滅 (@take18283) September 26, 2020
必須文書とはその字の如く、治験で必要な書類のことを指します。
治験で必要な書類は、かなり長い年月しっかりと保管をするように省令で定められています。
それ程重要な資料が保管されていないという状況は…CRAとしては愕然としてしまいこの表情になってしまうかもしれません。
「患者さんが逮捕されたんですか!?」
#ジブリで学ぶ臨床開発 pic.twitter.com/voKjrGy8fE— るな@株と医療ニュースメモ (@Luna11053) September 29, 2020
これはとても驚くシチュエーション。
ただ、Twitterを見てみるとチラホラとそのようなシチュエーションんに遭遇された方のお話もあるようで…
私は治験に入った患者さんが逮捕された場面には遭遇したことはないのですが、さすがにその患者さんの治験は中止になるのでしょうね…
色々と大変そうです。
えっ!?これから立ち上げの試験に移る代わりに来るはずだった後任がシックリーブになったから立ち上げといまの担当どっちもやれってどういうことですか?お賃金2倍にしてくれるってことですか?#ジブリで学ぶ臨床開発 pic.twitter.com/ChpnhtRX5p
— April (@April15593169) September 29, 2020
後任がシックリーブ…
シックリーブということはそれなりの期間離脱することになるので、引継ぎをしようと思っていたCRAにとっては一大事です。
当然、えげつない業務量が降りかかってくるわけですが(単純に2人分の仕事量)、そうなったら確かに賃金は2倍貰いたいですよね…
賃金は2倍になることは無いので、このCRAは泣く泣く対応をすることになりそうですが。。
せめてボーナスで還元してもらうなど交渉をしたいところですね。
医療機関サイドの視点
前回に引き続き今回の作品も微笑ましいものから強烈なものまで幅広くあります!
素晴らしい作品の数々を見ていきましょう。
日常系
マニュアルこんなに持ってるの、すごいでしょ。#ジブリで学ぶ臨床開発 pic.twitter.com/VvlgMtQXxV
— Lisphilar (@lisphilar) September 24, 2020
治験では、治験実施計画書という資料がメインではありますが、それだけでは全てをカバーできないので、計画書以外にも手順書というものがあります。
担当している治験の内容によって手順書の数は変わってきますが、この作品のご様子を見る限り物凄い量の手順書があるようですね…
現場にいるCRCさんはこの手順書に記載されている内容通りに対応を進めていく必要があり、ここまで手順書が多いと実際の業務はとても大変なことが想像できますね…
先生!1ヶ月で10例余裕なんて適当なことを言わないでください!選択除外基準ちゃんと見ましたか!?CRCのリソース考えてますか!?モニターさん!待って!メモしないで!#ジブリで学ぶ臨床開発 pic.twitter.com/xqKOx5inft
— April (@April15593169) September 25, 2020
先ほどメーカー視点の作品でも出てきましたが、先生が楽観視をして意気揚々とCRA(モニター)に見込み症例数をお話されたのでしょう。
CRA側でも、もちろん注意はしていますが、一定数そのまま先生の話を鵜呑みにしてしまうモニターもいるため、CRCさんとしてはハラハラドキドキしながら横で聞いているのかもしれませんね。
この作品では…鵜呑みにしてしまう系のCRAだったのでしょうね。
CRCさんの叫びは届いたのか気になるところです…!
とあるCRCのリアルな日常の一コマ「桜宮さん、なんか先生が呼んでま…」「あ、ごめん。今行く💦(visit後処理中)」#ジブリで学ぶ臨床開発 pic.twitter.com/r9Q8QmK0R5
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 25, 2020
CRCさんのリアルな日常の一コマの作品です。
被験者さんが来院された後は、資料の整理やデータ入力などやらなければいけない作業が盛りだくさん。
まだ片付いていないご様子ですが、作業中に呼ばれたらこのようになっているのでしょうかね。
…資料の紛失にはご注意を!笑
新しい領域の治験を担当する時の光景#ジブリで学ぶ臨床開発 pic.twitter.com/R4lOHIXvTg
— hawk (@haseyama616) September 26, 2020
新しい領域の治験はまさにこの作品のように未知の領域という感覚かもしれません。
もはや、どんな副作用が起きるのか、どれくらい忙しいのか、そもそも流れがあまりイメージ出来ないなど、手探りをしつつ対応を進めていく必要もあります。
医療機関サイドの視点の作品ではありますが、これはCRAとしても感じる部分かと思います。
治験経験が全くない新規施設で、SUM前にCRCが院内を出入りしはじめた時に多い院内スタッフさんの結構リアルな雰囲気。#ジブリで学ぶ臨床開発 pic.twitter.com/z6AWACRp9C
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 26, 2020
SUM(Start Up Meeting)とは、治験を開始する前に医療機関のスタッフ向けにおこなう治験の説明会のようなものです。
SUM前になると治験を開始する準備をするためにCRCさんが医療機関に出入りするようになります。
治験の経験が無い医療機関にとってはCRCさんは、”外部から来た治験の人”みたいな感覚を持たれるということでしょうか。
ヒソヒソとどんなことを話しているのか気になるところですが、非常にリアルな情景描写なのでしょうね!
えっ!??あれ??さっき先生に記載お願いします!って言ったのにもうお帰りになってるよ…忘れちゃったんだなぁ…記載物めっちゃ溜まってるのに…#ジブリで学ぶ臨床開発 pic.twitter.com/2vVs2d2foi
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 26, 2020
治験では色々と先生に記載してもらわなければいけない資料が発生します。
ただ、先生からしたら溜まりに溜まった資料に1つずつ記載をしていなければいけないので、正直なところ面倒に感じられていることもあるでしょう。
やらなければやらなければと思っていても後回しにすれば人は忘れてしまうもの。
それでも記載してもわなければいけないので、先生の時間が空いている隙を狙ってすっと入り込むCRCさんには脱帽です!
このVAS、23mmじゃなくて22mmじゃないですか? #ジブリで学ぶ臨床開発 pic.twitter.com/HAjGKqc2gi
— hawk (@haseyama616) September 27, 2020
VASとはVisual Analogue Scaleの略で、痛みなどを視覚的に評価する際に使われるものです。
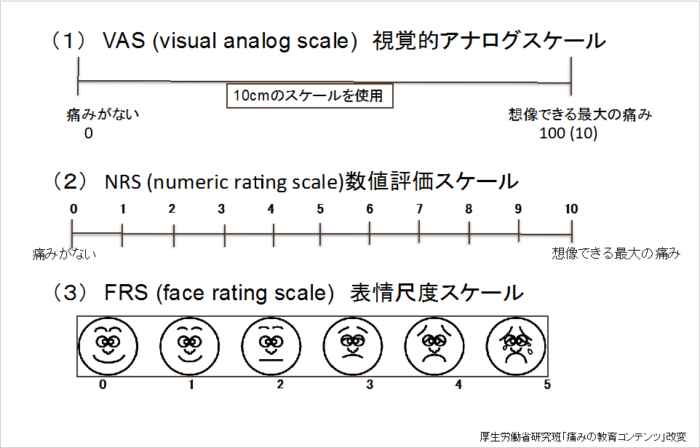
日本ペインクリニック学会のHPより抜粋
上のようなスケール表の該当する場所に「|」と被験者さんが線を入れ、それを読み取って治験で収集をしているデータ(EDCと言います)に入力をしていく必要があります。
その際に、「|」の位置が、22mmなのか23mmなのかによってEDCに入力すべき数値が変わってくるのですが、実はその位置が絶妙な時があり2人で見ても意見が割れてしまうことも。
CRCさんは23mmのつもりで入力をしても、CRAや監査官には22mmでは?と言われることも起こり得るということです。
若干太さがあるような「|」の場合は、左端で測るのか中央で測るのか右端で測るのかによって結果が変わってくる可能性があり、しっかりとしたルールが無ければ面倒くさいトラブルに発展しまうことも…
(SUM後、組入真っ只中のCRC)次は内諾説明して、別の方のICして、その後は残ってるSCR検査のWSの処理だ‼︎今日中にす・べ・て終わらせる‼︎#ジブリで学ぶ臨床開発 pic.twitter.com/xugUGo37AW
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 27, 2020
SUM後は、先生のモチベーションも高いことが多く、CRCさんとしてはスタートダッシュを決め込みたいところかと思います。
そんなこともあり、候補の症例がどっと入ってきてCRCさんからしたらてんやわんやの状態。
それでもこの作品のような気迫で一気に仕事を片付けてしまうCRCさん…
目が若干血走っているようにも見えますが、これくらいの気合が無ければ乗り越えるのは難しいのかもしれませんね。
おかしいなぁ〜被験者さん来院されないなぁ〜。昨日、電話の後にメッセージもしたんだけどなあ。あと10分していらっしゃらなかったら、ご連絡してみよ。#ジブリで学ぶ臨床開発 pic.twitter.com/vGEqd7GQyM
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 27, 2020
治験では決められた来院日に被験者さんに来院してもらう訳ですが、治験に入っていなければ普通は来ないタイミングでも来院してもらわなければいけないときがあります。(いつもは2ヶ月おきなのに治験に入ったら2週間おきに来院しなければいけない等…)
そんな中、予定の来院時間近くになっても被験者さんが来院されたないとCRCさんはこちらの作品のように「本当に来るかな?大丈夫かな?」とソワソワし始めちゃうのでしょうね。
私もきっと被験者さんから連絡が来ないか携帯を握りしめながらまだかまだかと待っていそうです。。
今日午前中visit対応で、できるところまでやっつけて午後から某市の病院のモニターアポか……1時間半かかるから…最悪タクシーやな。
電車遅れたら、モニターさんに、世間話で繋いでもらお(実話) pic.twitter.com/vRLcJRA9FX— や え (@yaesan0518) September 27, 2020
SMOに所属するCRCさんの場合は、いくつかの医療機関を掛け持ちで担当することがあります。
そして、この作品のように1日で複数の医療機関を渡り歩くこともあるようで、なかなかハードなスケジュールで動かれているようですね。
ギリギリを攻めなければいけないこともあり、電車の遅延があれば次の医療機関への到着が遅れてしまうことも。
CRCさんの到着までモニターが世間話でなんとか繋いだという経験談もあり、モニターは緊急事態に備えて何か話せる話題をしっかりと持ち合わせていた方が良いのか知れませんね、笑
先生、まだこの試験エントリーできないってお話しましたよね。モニターさんから連絡来たらすぐ言いますから、とにかく今はまだ駄目です。#ジブリで学ぶ臨床開発 pic.twitter.com/aole2NlkYz
— 駆け出しCRCうづき (@CRC93325171) September 28, 2020
治験では色々な決まりごとがあり、被験者さんを組み入れ始めるのにもタイミングが規定されています。
やる気まんまんの先生の場合、フライングで候補患者さんを治験に入れようと動いてしまうことも。
そんな前のめりの先生にも穏やかな表情で静止するCRCさん。
これ以上同じことを繰り返すと穏やかな表情から一変、先生に雷が打ち付けられるかもしれませんね。
それ、SOPにはなんて書いてあるの?じゃぁGCPには?ICHも見た?
#ジブリで学ぶ臨床開発 pic.twitter.com/OYt9cqVmHm— しましー (@crcshimasy) September 28, 2020
先ほども少し書きましたが、治験は色々な決まり事が定まっていて、そのルール通りに実施する必要があります。
治験の手順などについては、治験実施計画書や手順書を確認するのですが、手続き的な対応については、医療機関でのルールであるSOP、そして治験共通の決まりごとが記載されているJ-GCP(日本用)やICH-GCP(グローバル用)をまず確認する必要があります。
若手の場合、よく分からなくて質問をするのですが、そんなときにはこの作品のようにしっかりと資料を確認してから来ているのか問われることになるでしょう。
このシチュエーションはCRCさんもCRAも共通ですね!
え?2週間で20例入れろって?やだなー、10営業日しかないのに、無理に決まってるじゃないですかー。あははは!
#ジブリで学ぶ臨床開発 pic.twitter.com/Cy06uhIGmq— hawk (@haseyama616) September 28, 2020
医療機関サイドからすると、時々無茶ぶりな要求をCRAから受けることがあります。(もともとは依頼者(メーカー)が指示をしている場合が多い)
あまりにも”無謀だろ!”と思われる要求を医療機関として受けた際には、このような感じでもはや笑いしか起きない状況なのかもしれません。
もちろんモニターは本気ですよ!(内心は知りませんが…笑)
月内に契約してほしいSMOさんと、契約は正直急がないしっていうCROさんの狭間でキレるミー(院内事務局)#ジブリで学ぶ臨床開発 pic.twitter.com/rUMez7KyWo
— しましー (@crcshimasy) September 29, 2020
SMOの場合は、締め日等の関係から契約を「月内にして欲しい」などの要望がある場合があります。
ただ、CROにとって特に急ぐ必要がなければ時間や精神的にも余裕を持って対応をしたいので、わざわざ急ぐ必要も無いと判断されることもあります。
院内事務局はSMO、CROどちらにも属さないので、「どっちなの!?」とイラついてしまうこともあるのでしょうね。
この作品からはキレている様子が凄く伝わりますね…!
白衣を着た仕事中は大抵気難しい雰囲気を醸し出しておられる院長先生と帰りに遭遇した時。#ジブリで学ぶ臨床開発 pic.twitter.com/G9NcfyNXoe
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 29, 2020
このおじいちゃんは確かに何故か院長先生的なオーラを感じますね。
普段は温厚な院長先生でも、白衣を着たときには気難しい雰囲気を醸し出す先生が多いのでしょうか。
CRAの場合、会うとしてもほとんど白衣を着た状態の院長先生しか見ることはないと思うので、他の場面ではどのような感じなのかも気になるところですね!
あまり忙しくない施設の治験事務局
#ジブリで学ぶ臨床開発 pic.twitter.com/cD747afrMl
— DskeM (@dske1124) September 29, 2020
治験が多く走っている治験事務局は鬼のように忙しい日々を送っているとよく聞きますが、治験がほとんど走っていないような治験事務局の場合、確かにあまりやることが無いかと思うので、このようなゆったりとした雰囲気になるのかもしれません。
治験が1本も走っていない治験事務局は普段どんな感じで仕事をしているのか私も気になるところです…
トラブル系
え、土曜日に入院してたですって??
#ジブリで学ぶ臨床開発 pic.twitter.com/CzMD2PwtKh
— DskeM (@dske1124) September 26, 2020
治験に参加している被験者さんが入院をしてしまった場合、重篤な有害事象というものに該当し、ほとんどの治験では24時間以内に治験責任医師から治験依頼者(メーカー)に報告をしなければいけません。(実際には、間にCRCさんやCRAが入って対応をします)
つまり、入院をしたときは、直ちに対応をしなければいけないのですが、土日に入院が発生してしまうと週明けにその事実を知らされることもあり、CRCさんとしては「え…?」というリアクションになることでしょう。
なんだと‼︎これがプロトコルからの逸脱になるだと⁉︎こんな小さい文字で注釈に書かれていたとは…#ジブリで学ぶ臨床開発 pic.twitter.com/MBg75RARSV
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 27, 2020
時々トラップのように小さい文字で注釈に「~~とする。ただし、~~の場合は除く」等が書かれていることがあります。
普通に対応をしていたら見落とすようなものが多く、それを知った時には”なんでそんな大事なことがこんな小さく!?”と思うこともあるでしょう。
…はい、私も資料を作る時は気を付けるようにします!
待ってるの。IWRSが繋がるの。
#ジブリで学ぶ臨床開発 pic.twitter.com/DpQ9BmRO2u— hawk (@haseyama616) September 29, 2020
IWRSとは、主に治験薬の割り付けをするときに使用するシステムのことです。
被験者さんが来院され、治験薬の処方がある場合には、このIWRSによって発番された治験薬を被験者さんに処方する必要があります。
ただ、このIWRSが時々サーバーの不調等で接続が不安定となることがあります。
そうなると、治験薬の発番が出来ないため、被験者さんに治験薬を処方することが出来ません。
患者さんには治験薬を渡さなければいけないので、システムが復旧するまで被験者さんに医療機関内で待っていてもらう必要があります。
この作品では夜になっていますね…
作品では笑っていますが、ここまで対応が遅くなると医療機関サイドからクレームが入る可能性があるので、CRAや依頼者としては冷や汗ものです。
(白衣の胸ポケットに入れた業務携帯がいきなり震える)ぅっ…今は電話は取れないんだ…診察に立ち合ってる最中なんだ!お願いだ、後でかけ直すから今はダメだ…!#ジブリで学ぶ臨床開発 pic.twitter.com/p9buhYUDGY
— °×.*桜 宮*.+° (@Oumiya_0721tDk) September 29, 2020
CRCさんが白衣の胸ポケットに携帯を入れて、被験者さんの診察に立ち会っているところですね。
そんなときに着信が入っても直ぐには出られないもの。
それでも容赦無くバイブレーション攻撃が襲ってきてCRCさんにダメージが入っているようです。
CRAはCRCさんに電話をすることがよくあると思いますが、しばらくコールをしても出ないときは空気を読む必要がありますね。
ひたすら掛け直してCRCさんにダメージを与え続けた場合、怒りの鉄槌が下されることにもなりかねません。
やっべー、雷なってる、治験薬保管庫大丈夫かなー⚡
️停電しないでよ、明日治験薬の払い出しあるからね(マジ)💊 pic.twitter.com/R3D7ie3VSa— や え (@yaesan0518) September 29, 2020
治験薬については、保管温度がしっかりと決まっています。
この様子だと室温保管ではないのでしょう。
冷蔵庫に入れて保管をしている場合、雷で停電してしまうと当然内部の温度が上がってしまい、温度逸脱となり治験薬が全て使えない状況になってしまう可能性があります。
治験薬の払い出しまで期間がある場合は、再搬入をするれば良いのですが、作品の状況では、明日払い出しがある予定なので、再搬入は間に合いません。
こうなってくると神頼みということになってしまいます…(私は停電で温度逸脱になって治験薬がパーになったところを目撃したことがあります…)
次のIRBの資料締め切りは昨日だよ
#ジブリで学ぶ臨床開発 pic.twitter.com/qqn25kBMhe
— しましー (@crcshimasy) September 29, 2020
一言ですが、非常に破壊力があります。
きっとこの事実を知らされた方は、冷や汗が出ていることでしょう。
IRB(治験審査委員会)は、月に1回開催されていることが多く、資料の締切日に間に合わなかった場合はIRBでの審議が1ヶ月遅延することになります。
CRAでやらかしてしまった場合、1日オーバーであれば治験事務局に本気で謝罪をすれば受け付けてくれる可能性もありますが、受け付けてもらえなかった場合でも文句は言えません…
IRBの資料締切についてはしっかりと厳守できるように締切日を忘れないよう対策をしておくことが大事ですね。
先生やる気で…ICする患者さん来週の外来からピックアップしてくれてたのに…さっき依頼者さんから製剤の都合で一旦同意取得ストップって言われたの…
先生になんて言おう…
私…上手く言えるかな…#ジブリで学ぶ臨床開発 pic.twitter.com/JL64rCG93A
— しましー (@crcshimasy) September 29, 2020
治験を始めるには当然治験薬が必要です。
治験薬を作るのに、回収率が想定よりも下回ってしまった場合はロット数が確保できず医療機関に治験薬を搬入出来ないという状況になってしまいます。
これは完全に製薬メーカー側の問題であり、それをやる気満々の先生に伝えるとなると、水を差すことになりかなり言い出しにくい状況かと思います。
製薬メーカー側はある程度余裕を持った製剤計画を練ることも大切なのでしょうね。
無いの…ファイルが一冊見当たらないの…必須文書…この試験はあと15年とっておかなきゃいけないのよ…違う人の目で探したら見つかるのかしら…
#ジブリで学ぶ臨床開発 pic.twitter.com/BqcSlNcFM7
— しましー (@crcshimasy) October 1, 2020
治験ではかなりの長期間、治験関連の資料を保管しておく必要があります。
そして、その資料については、当然紛失することはあってはならないことで、ファイル1冊分の資料が無くなるのは医療機関としても冷や汗が出るくらい恐ろしいことです。
案外ひょっこり出て来たりすることもあるので、ここは他の人の助けも借りながら探すのが良いのかもしれませんね。
まとめ
今回も非常に多くの作品を紹介させていただきました!
前回に引き続き非常にハイレベルな作品ばかりでしたね。
スタジオジブリでは、今後ももしかしたら画像のリリースがあるかもしれないので、その際にはまたプロ達によるハイセンスな作品を是非見てみたいものです!
その際はばっちりまとめ記事第3弾も作成させてもらいます。
最後に…
今回は「#ジブリで学ぶ臨床開発」でしたが、フォロワーのチクチクさんが「#ジブリで学ぶMR」のまとめ記事をリリースされています。
MRバージョンも本当に楽しかったので、気になる方は覗いてみてはいかでしょうか。
皆様。御機嫌よう!社畜のチクチクです。ジブリで学ぶMR前編では多くの応援のお言葉ありがとうございました。正直、まとめ記事作るのかなりめんどくさ…(ry オィ!! 皆さんの励ましのおかげでこの記事かけています。なお当記事は後編です。 まだ前編をご覧になっていない方は 前編:【MR業務の基本編】からご確認ください。






.jpg)


“「#ジブリで学ぶ臨床開発」をまとめてみた~第2弾~” への2件のフィードバック