がついに始動!.jpg)
昨今の日本の薬価制度ではドラッグラグ/ドラッグロスの本格的な再燃が危惧され、私たち臨床開発職も創意工夫を凝らした革新的な手法の確立を目指しています。
今回は日本臨床試験倫理審査機構の代表理事・一法師さんとの対談も含めてお伝えしていきます。
 のりす
のりす 治験業界でかれこれ10年以上働いています。Twitterでのフォロワー数は4,000人程。今回は新たなセントラルIRBの可能性について触れていきます!
ドラッグラグ/ドラッグロス問題に対して臨床開発職としてできること

現在の日本の薬価制度では革新的医薬品の価格が大幅に引き下げられる状況であり、この状況が長引くと日本での医薬品開発は不活発化し、結果としてドラッグラグ/ドラッグロス問題の本格的な再燃に繋がることが危惧されます。
日本の医薬品開発の環境を守るためには、薬価制度の見直しという根本的な対策が求められるところですが、残念ながら根本的な対策はそう簡単に実現できるものではありません。
もちろん、「日米欧製薬3団体共同声明:2024 年度(令和6年度)薬価制度改革への提言」のように業界団体からも働きかけはしていますが、未だ変革の兆しは見えずにもどかしい気持ちでいます。
では、何もせずに指をくわえて見ているのかというとそういう訳にもいきません。
臨床開発職としてもこの大きな課題に対して多方で創意工夫を凝らした革新的な取り組みを行い開発コストの削減/開発の迅速化に奔走しています(ただのコスト削減ではなくて試験の質の維持もしながらなので大変!)。
具体的にはDCT、RWD/RWE、ブロックチェーンを活用したモニタリングあたりが注目を浴びていますね。
そして、私の中ではこの「革新的な取り組み」の仲間に「“次世代”セントラルIRB」が新たに加わるのではないかと考えています。
セントラルIRB自体はかつてから存在しますが、私はあえて“次世代”セントラルIRBと勝手に命名をしています。
わざわざ「次世代」と付けているのは、セントラルIRBが進化することで日本の医薬品開発の迅速化により絶大な効果が発揮できると信じているためです。
では、その次世代セントラルIRBとはどのようなものなのでしょうか?
日本は海外と比較すると医薬品の開発コストやスピードの面で課題が残されており、今後更に発展すると思われるグローバル試験に参加していくためには課題の解決が求められます。 課題解決の可能性がある1つとして今回は「セントラルIR …
次世代セントラルIRBがもたらす変革とは?

セントラルIRBは複数の施設の審議を一括して対応することができるため、「セントラルIRBの導入を依頼者で決定するために必要なことを考えてみる」の記事でもご紹介したように治験実施の円滑化、更には開発コストの削減に繋がることが期待できます。
ただ、現在の日本のセントラルIRBはある一定の枠組みの中で利用されることに留まっている印象があり、その枠組みを超えたセントラルIRBはほぼ存在していないと思います。
更にセントラルIRBは「治験実施の円滑化に貢献する」という目的達成のための“手段”の1つであることから、セントラルIRBを使用しているのに手続きが煩雑化するようでは本末転倒です。
今までの枠組みを超えて、治験実施の円滑化に特化した(もちろん質は落とさずに)セントラルIRBこそが次世代セントラルIRBなのだと考えています。
今までのセントラルIRB
2008年以前は、施設で治験をやるためには自施設にIRBがなくてはならず自施設でIRBを設置できる大規模病院での治験がほぼ全てでした。
ところが、2008年のGCP改正により施設毎のIRBの設置が廃止されクリニック等の小規模な施設に転機が訪れます。
自施設にIRBを持たない小規模な施設でもセントラルIRBを利用することで治験実施施設となることができるようになったのですね。
そのため、クリニックでの治験の支援体制の確立、セントラルIRBの整備が進み現在ではクリニックでも多くの治験が実施されています。
その立役者になったのが、SMO業界。
製薬協の調査によるとセントラルIRBを使用している施設は2016~2017年時点で全体の54.5%であり、その内訳の大半はSMO主体のセントラルIRBで占められていることが分かります。
.png) 出典:治験環境の変化~16年間のアンケート調査から~(Clinical Research Professionals No.77)
出典:治験環境の変化~16年間のアンケート調査から~(Clinical Research Professionals No.77)
つまり、セントラルIRBを利用しているのは現在も大半がクリニックであることが推測できます。大規模病院ではなかなか普及が進んでいないということですね。
しかし、この大規模病院にセントラルIRBを普及させていくことこそが日本の医薬品開発の迅速化には欠かせない要素になっていると思っています。
大規模病院でのセントラルIRB導入はなぜ効果的?
医薬産業政策研究所の報告によると、2021年末調査時点においてFDAで承認されており国内で未承認である253品目のうち抗悪性腫瘍薬が52品目(21%)と最多の割合であるとのことです。
このことからドラッグラグ/ドラッグロスが深刻化しそうなのが抗悪性腫瘍薬であることが何となく推測できそうですよね。
では、この抗悪性腫瘍薬の治験はどのような施設で多く実施されているでしょうか?
そう、大規模病院(大学病院やがんセンター等)ですよね。
PMDAが公開している「治験計画届出件数の推移(薬効別分類)」を見ても、令和3年度では抗悪性腫瘍薬の割合が全体の44.8%を占めておりダントツに多いことが分かります。
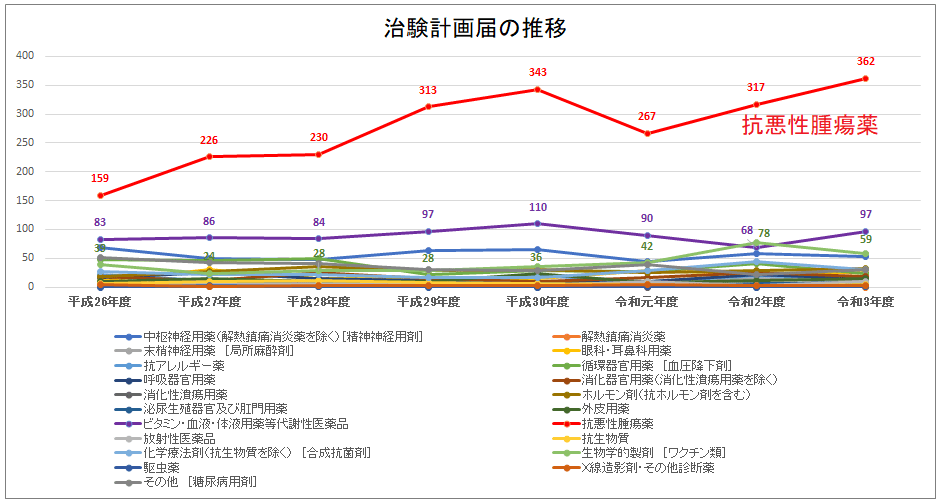 PMDAが公開している「治験計画届出件数の推移(薬効別分類)」を元に当ブログで作成
PMDAが公開している「治験計画届出件数の推移(薬効別分類)」を元に当ブログで作成
つまり、大規模病院に治験の依頼が集中してしまっていることが予測されます。
質の高い審議をするためには、時間の確保も必要であることから1回のIRBで審議できる案件数にも限りがあります。
そのため、初回審査が数か月待ちということも経験がありますし、結果として組み入れ開始時期の遅延にも繋がってしまいグローバルからネガティブな印象を抱かれてしまった経験もあります。
組入れ開始時期の遅延は治験の終了時期にも影響しますし、これが抗悪性腫瘍薬の治験を多く扱う施設で起きてしまうと…日本のドラッグラグ/ドラッグロス問題にとって大きな打撃となることは想像に容易いですよね。
これからの日本の医薬品開発には次世代セントラルIRBの登場が求められている…
では、次世代セントラルIRBなんて今後できるのかと思いますが…ありました!
2023年6月に始動したばかりの日本臨床試験倫理審査機構が設立したセントリオール・ワンがまさに私が思い描いているIRB像に近く衝撃が走りました!
日本臨床試験倫理審査機構の代表理事・一法師さんにお話を伺ってみた
 出典:日本臨床試験倫理審査機構公式HP
出典:日本臨床試験倫理審査機構公式HP
私たち依頼者側からの印象ではIRBは正直少しお堅いイメージがある方も多いかと思いますが、日本臨床試験倫理審査機構が設立したセントラルIRB・通称セントリオール・ワンはTwitter(@Centriol_ONE)の運用もしており非常にオープンな活動をされているという特徴があるIRBです。
Twitter上には意外にも施設側・依頼側の方々が多く登録されており現場の生の意見が日々取り交わされています。
その現場のリアルな声を取り込んで成長をしていく…まさに今までの既成概念を打ち壊す斬新なIRBですよね!
今回はセントリオール・ワンの生みの親である日本臨床試験倫理審査機構の代表理事・一法師さんにお話をお伺いしていこうと思います。
セントリオールが目指しているゴール
 のりす
のりす 本日はよろしくお願いします!では早速ですが、まずはセントリオールが目指しているゴールとはどのようなものか教えて下さい!
 一法師さん
一法師さん 簡潔に言うと、「審査の質を落とさずに、1治験1IRBを当たり前にする」でしょうか。私共の力だけではどうしようもない部分も多いのですが、業界の常識が変わっていくための一つのきっかけになれればという想いがあります。
 のりす
のりす 「1治験1IRB」は業務効率的な観点からもそうですが、”一貫性を持った視点で全施設の審査ができる”という大きなメリットがあると思っています。
今の日本の医薬品開発を取り巻く環境はなかなか厳しいものがあるのでそこに一石を投じる…なんだかワクワクしてきますね!
セントリオールのオリジナリティー
 のりす
のりす 現在もセントラルIRBというものは多々存在していると思いますが、セントリオールのオリジナリティーについて教えて下さい。
 一法師さん
一法師さん 被験者保護を最も重要視しているという点は他のIRBと共通ですが、セントリオールのオリジナリティーとしては「完全な中立性」、「本質と効率の両立」、「薬事行政経験者の存在」の3点であると考えております。
 のりす
のりす 「完全な中立性」、「本質と効率の両立」、「薬事行政経験者の存在」…それぞれについて簡単に教えていただけますか?
 一法師さん
一法師さん 1つ目の「中立性」ですが、セントリオールは中立性の高いIRBでして、あらゆる治験関係者(医療機関や医療法人、治験ネットワーク、SMO、CRO、製薬企業など)から完全に独立しているIRBはおそらく日本では唯一ではないかと考えております。
IRBは審査を行う立場ですので、一般論として、治験関係者から独立している方が望ましいですし、「みんなが使えるIRB」と謳っているとおり依頼いただく医療機関の制限・グループの垣根もないため、目標である「1治験1IRB」を達成する上では重要な要素であると考えております。
 のりす
のりす なるほど!確かにあらゆる治験関係者から完全に独立しているIRBは私が知り限り日本ではありませんね…
主観ですが、セントラルIRBが治験誘致のオプション的な位置付けとなっているのでどうしても制限がある感じですかね。
本来は開発促進の役割も担っているので、「この施設でやればセントラルIRBが使えますよ」ではなくて、「どこでやってもセントラルIRBが使えますよ」というのが理想ですよね。
 一法師さん
一法師さん 2つ目の「本質と効率の両立」については、被験者保護と信頼性確保という本質を押さえつつも、貪欲に効率化を進めていくという姿勢です。
具体的には、『委員会は毎週開催』『審議資料等は電磁化』『資料提出期限を1週間程度にまで短縮』などがありますが、そのほかにも要望があれば、フレキシブルに取り入れていきたいと思います。
 のりす
のりす 本質的な部分はもちろんのこと、依頼者の立場としては貪欲に効率化を進めていただけるというのは本当にありがたいです!
最近では、i-Padを使った審査をされているIRB等も増えてきて徐々に変革を感じますが、更に「使いやすく」を追求いただけるのは心強いです!
 一法師さん
一法師さん そして3つ目が「薬事行政経験者の存在」です。
法人の理事や委員会委員に当局の立場で治験に携わってきた者を複数含みますので、法令を遵守した厳格な運営をお約束するのは当然ですが、それに加え規制側の考えを熟知していることを活かして、審査の本質という点でより適切な審査をご提供できるのではと自負しております。
 のりす
のりす とても魅力的であると同時に、正直なところ「審査が厳し過ぎたら嫌だなぁ」というのも実は本音だったりします(笑)
委員の方が厚労省やPMDAの方だったと思うと少し身構えてしまうと言いますか…その辺りについて実際のところどうなるのでしょうか?
 一法師さん
一法師さん お気持ち良く分かりますよ(笑)
ただ、基本的にご心配は無用だと思います。前に述べた「規制側の考えを熟知している」というのは、『治験のデータが承認申請後どのように使われるのか?』や『倫理的に問題となる事例や信頼性が確保できていないと判断され得るGCP不遵守の程度』を把握しているということですので、GCPの本質に影響しないような不必要で細かい指摘はむしろ減ると考えています。
なお、被験者保護とデータの信頼性確保を脅かすような試験内容や事例については、当然、審査をする上で厳しく追及してまいりますが、これは他のIRBも同様だと思います。
 のりす
のりす 時々IRBで「その質問は倫理的や科学的な妥当性を判断するために必要な本質的な質問なのかな?」と思うご質問を頂くこともあるので、不必要で細かい指摘が減るというのも嬉しいですね。
特に現場サイドとしては、ICFの修正指示(内容は軽微)を恒例のように行っているIRBもありますので、本質的な視点で見ていただけるのであればむしろ依頼者側にとってもプラスが大きいですね!
症例集積性と開発コスト削減への貢献度合い
 のりす
のりす 症例集積性や開発コスト面から日本が国際共同治験から外されてしまうという危機感を強く持つ場面が増えてきました。
製薬メーカーで仕事をしていても最近は日本の立場が危うくなっていることをひしひしと感じています。
私たちとしては何とか日本の存在感を欧米にアピールしておきたいところですが、セントリオールを利用することでどの程度症例集積性と開発コストの削減に影響があると思いますか?
 一法師さん
一法師さん セントラルIRBによる一括審査による治験依頼者側の一般的なメリットとしては、のりすさんのブログにもあるように「手続きの効率化や早期の治験開始」があります。
セントリオールではそれに加えて、前述の「本質と効率の両立」で例示したような運営により、サイトオープンまでの期間をさらに1~2か月程度短縮し、また、CRAの方の手間もより低減できると考えています。
 のりす
のりす サイトオープンまでの期間が更に1~2ヶ月程の短縮とは!
私たちにとって1~2ヶ月の短縮はコスト削減のみならず非常に大きな意味を持っています。
患者さんからしても「1日でも早く」という想いかと思うので、とても魅力的ですね!
 一法師さん
一法師さん 複数施設を一括で審査することにより1施設当たりの審査費用も下がりますので、開発コストの削減にもつながりますし、その結果として、施設追加に対してより積極的になることもあり得るのではと予想しております。
症例集積性にはその他多くの因子が影響するため、そんなに単純ではないと思いますが、セントリオールをご利用いただくことによって「サイトオープンまでの期間短縮」×「施設数増加」となり、症例集積に必要な期間の短縮(期間が同一の場合は日本の登録症例数増加)という点でも貢献できればなと考えております。
 のりす
のりす 確かに、今よりも1施設あたりの単価が下がれば施設数を増やして治験期間の短縮を目指したいところですね。
お話を聞けば聞くほどメリットばかりしかないなと感じます!
セントリオールに審査を依頼する施設側のメリット
 のりす
のりす 私はセントラルIRBを使うことは日本が国際共同治験に参画するためにも必要な要素のうちの1つと考えています。
ただ、施設側から見たら場合によっては「依頼者側のみに都合が良いものでは?」と思われることもあるかもしれません。
セントリオールでの審査は施設側にはどのようなメリットがありますか?
 一法師さん
一法師さん 当該試験のみで考えると「依頼者に好まれるため、施設選定の候補に挙がりやすい」という点を除けば、確かに施設側のメリットは限定的だと思います。
しかし、他の試験も含め当該医療機関全体で考えると、施設のリソースの有効活用という意味でメリットと言える点もあるのでは?と考えます。
 のりす
のりす もう少し具体的に教えていただけますか?
 一法師さん
一法師さん 多くの試験を実施されていらっしゃるご施設では、委員会委員および事務局の方のご負担は相当なものだと思います。
一部の試験だけでも審査を外部に委託すれば、本当に当該施設が重要視している試験――例えば、FIH試験、新作用機序の薬剤を使用する試験、急性疾患や重篤な疾患を対象とした試験など――にこれらのリソースを集中することができます。
優先順位をつけて対応することは、現場の担当者のQOLを考える上でも重要だと思います。
 のりす
のりす 施設の方とお話をしていても結構人手が足りないというお話も聞きますからね。
 一法師さん
一法師さん また、メリットという観点からは少し話が逸れますが、外部IRBを使用する予定は当面ないとお考えのご施設におかれましても、外部IRBと基本契約だけでも締結しておいていただけると、『緊急時に限り、例外として外部IRBも選択できる』という選択肢ができます。
そうしますと、例えば、「数か月の審査待ちが発生しているが、医療者の責務としてどうしても緊急で開始すべき試験」といったケースにも柔軟に対応できる体制となりますので、実際にそのオプションを行使することがなかったとしても、リスクマネジメントという観点から非常に有意義であると考えております。
 のりす
のりす 基本契約を締結しておくというやり方は施設とSMOさんの契約形態でもよく見られますよね。
基本契約のみ締結をしていてセントリオールを実際に使っていない期間というのは施設側の支払いは無いという認識であっていますでしょうか?
 一法師さん
一法師さん はい。「基本契約の締結」については費用は何も発生しませんので、緊急時対応可能な体制の構築にご利用いただければ幸いです。
 のりす
のりす なるほど!であれば、いざという時のために基本契約だけとりあえず締結しておくという手もありそうですね。
患者さん目線では、そのような医療機関で治験が実施されているとより安心ですね。
一方で、外部IRBの利用によって審査費用収入がなくなることを懸念する声もあるようですが、その点についてはいかがでしょうか?
 一法師さん
一法師さん 外部IRBの利用した試験では「審査費用」を請求できなくなり、治験収入が減ることを懸念されるご施設もあるかと思います。
しかしながら、院外で審査するとはいえ一定の事務局業務は引き続き院内に発生しますので、もし通常請求されている「審査費用」に「事務局の運営費」が事実上含まれているのであれば、その費用を別途請求することは正当な行為ですし、それで懸念が解消する場合もあるのではないでしょうか。
 のりす
のりす 確かに仰る通りですね。
依頼者の立場からも事実としてやっている業務に対して費用をお支払いするのは正当だと思いますので納得感はあるかなぁという印象です。
審査内容や資料提出期限
 のりす
のりす 「Centriol-ONE(セントリオール-ワン) 利用の手引き」を読んだのですが、一番驚いたのは依頼者が出席する場合に限り初回審査の資料提出期限がIRBの1週間前でOKという点でした。
依頼者の出席はCROでも可能か、また出席時には依頼者からどのような説明が必要になりますか?
 一法師さん
一法師さん 「手引き」には簡略化して『依頼者』と記載していますが、ご説明いただける方であれば所属は問いませんので、CROの方でも全く問題ございません。
また、出席時は、試験概要の簡単なご説明および質問へのご回答などの対応をお願いします。
 のりす
のりす この辺りのルールは私が今まで経験してきた多くのセントラルIRBと同じなので違和感は無く安心しました。
手引きを見るとIRB開催の3週間前の資料提出の場合は依頼者の当日出席は不要とあったのですが、こちらについて詳しく教えていただけますか?
 一法師さん
一法師さん 委員は、担当試験の分担、チェックリストの活用などによって効率的に準備しますので、1週間という期間で要確認事項の精査等は可能ですが、それを事前に取りまとめて治験依頼者(又は医療機関)に送付し予め回答を入手するほどの時間的余裕はありません。
そのため、疑義等は委員会当日に質問させていただきますので、前述のとおり適宜その場でご回答いただければと存じます。
なお、資料提出から委員会当日まで3週間ほどお時間をいただける場合は、委員からの質問の取りまとめと依頼者側への送付およびその回答入手なども一通り完了させた状態で委員会当日を迎えられますので、スポンサー側のご担当者様は当日出席いただく必要はございません。
 のりす
のりす なるほど。3週間前提出の場合は、IRBからの質問が事前に送られてきてそれに回答をすれば良いという事ですね。
ご質問によってはIRBに出席をした担当者が回答できないこともあるので、事前に文面で送付いただけるのは非常に助かります。
立上げ時期は何かと忙しいので3週間前の提出が出来るかは微妙なラインですが、出来れば活用していきたいなと感じました!
審査対象
 のりす
のりす SOPの第11条には迅速審査に関する規定が記載されていますが、監査担当者の変更や連絡先の変更なども審査対象(迅速審査)が必要であるように読み取れます。
これらは、院長への報告のみという対応は不可なのでしょうか。
 一法師さん
一法師さん IRB審査の本質を考慮しますと、セントリオール側としては必要最低限の範囲でOKと考えておりますので、例に挙げていただいた案件については基本的に審査は必須ではありません。
しかしながら、法令上必須のもの以外は、IRBに審査依頼するかどうかは医療機関側が判断するものであると理解しておりますし、各施設がこれまで院内IRBで運用してきた方針もあると思いますので、各医療機関のご要望に応じて個々に対応していく予定です。
 のりす
のりす セントリオール側としては基本的に審査は必須としないということなので、この辺りの感覚も今までとは変わらないので違和感が無くて安心しました!
審査の結果概要
 のりす
のりす IRB審査の結果概要のマスキングについて結果公表前に相談させていただくことは可能なのでしょうか?
 一法師さん
一法師さん はい。会議の記録の概要については、ガイダンスに則って「議題(試験名等)」や「主な議論の概要」を記載しますが、公開前に予め関係各者にご確認いただきまして、ご要望に応じてマスキング等の措置を講じます。
 のりす
のりす マスキングに関しても柔軟にご対応いただけるのですね。助かります!
必須文書SDV
 のりす
のりす 手引きやSOPを見る限り、依頼者や施設側からの個別の要望が無い限り発生する資料は全て電磁化されている印象を持ちました。IRB保管分の必須文書SDVをする際には、Agathaのアクセス用アカウントがCRAに付与されリモートでの必須文書SDVとなる想定でしょうか?
 一法師さん
一法師さん はい。基本的に資料の授受、保存は全て電磁化いたします。おっしゃるとおりSDVの際はリモートがメインになると考えています。
 のりす
のりす 資料の提出、保管、SDV(原本確認が必須の資料以外)が全て電子で完結するのは今どきのIRBという感じがしました!
セントラルに資料が集約されていて、かつリモートが活用できるのであれば効率面では全く申し分無い環境ですね。
試験共通ICFの啓発
 のりす
のりす 初回審査の資料で準備をするのに最も負担が大きい資料は、施設版ICFかと思います。
全施設共通のICFとすることで施設側、依頼者側双方の負荷が減り、更に全施設で同一の内容を被験者様に公平に提示できるというメリットもあります。
倫理的な観点からもどの施設で治験に参加をしても公平に情報提供されることは健全であると感じますが、審査をする側の立場として試験共通ICFの推奨等の啓発を行っていくご予定はありますか?(ICFはPI作成ということを踏まえると難しいかもしれませんが…)
 一法師さん
一法師さん 少なくとも現時点では、私共のIRBから、試験共通ICFの作成と使用を義務付ける予定はございません。
確かにおっしゃっていただいたようなメリット(施設側・依頼者側双方の負荷減少や被験者の方々への公平性)は承知しておりますし、IRB側としても確認の手間が大幅に減ってありがたいのは事実です。
しかし、これは少し個人的な考えになりますが、ICFを実際に使用するのは医療機関の医師やCRCの方々ですので、説明しやすさ・患者さんへの伝わりやすさという点で「施設ごとのスタイル・好み」の部分が割と重要なのではないかな、と考えております。
したがいまして、ICF共通化はウェルカムですし将来的にはそちらに収束していくように思いますが、セントリオール側から指示する予定は今のところございません。
 のりす
のりす 確かにICFで最も重要なことはしっかりと患者さんに内容が伝わることですよね。地域性などによってももしかすると表現の仕方を変えた方が良いとかはあるかもしれません。
となると、ICFの統一化は慎重に議論する内容になるのでセントリオール側から指示をするというのは少し違う気もしますね。
依頼者としてセントリオールでの審査をお願いしたい時
 のりす
のりす 依頼者としてセントリオールで審査をしてもらいたいと思った場合には具体的にどのようなアクションを取れば良いのでしょうか?
 一法師さん
一法師さん まずは一度IRB事務局(information★centriol-one.com)宛てにご連絡ください。審査希望時期や試験の概要、予定している施設数などをヒアリングさせていただきながら、費用や契約手続き等についてご説明させていただければと思います。
具体的な審査依頼がなくても、ご相談や細かい運用部分のお問合せも随時受付け中ですので、まずはお気軽にご連絡下さいますと幸いです。
 のりす
のりす イメージとしては、治験実施医療機関が概ね決まるくらいのタイミングということですかね。
施設-セントリオールの契約締結を初回IRB前までに完了させる必要があることを考えると、なるべく早めにご相談をした方が良さそうですね。
最後に
 のりす
のりす 色々と質問をさせていただきましたが、1つ1つ丁寧にご回答いただきましてありがとうございました!
それでは最後にご施設、依頼者にメッセージがありましたらお願いします!
 一法師さん
一法師さん 治験依頼者と実施医療機関そしてIRBは、それぞれ立場が違いますので、ときに主張や要望が異なることもありますが、「新しい薬を少しでも早く患者さんに届ける」というゴールは共通だと思います。
このゴールを達成するため、それぞれが少しずつ歩み寄りつつ、一緒に日本の治験環境をさらに良くしていきましょう!
 のりす
のりす 日本の治験環境をより良いものにしていくには、各ステークホルダーが一丸となって立ち向かわないといけませんもんね!
是非一緒に頑張っていきましょう!
今回はインタビューにお答えいただきましてありがとうございました!!
 一法師さん
一法師さん こちらこそありがとうございました!
まとめ
今回は日本臨床試験倫理審査機構の代表理事・一法師さんにお話をお伺いしていきました。
私も数々のIRBに参加をさせてもらいましたが、ここまでオープンに情報発信や情報収集をしているIRBは初めてで今までに無い新たな可能性を感じました。
ドラッグラグ・ドラッグロスが拡大をすれば世界との医療格差が生れてしまい日本の医療の発展にも大きな弊害となってしまいます。
この大きな問題には施設側、依頼者側、そしてIRBも一丸となって挑んでいき日本の医療の発展を守っていきたいですね。







“IRBの変革期!?日本臨床試験倫理審査機構のCentriol-ONEがついに始動!” への1件のフィードバック