
日本は海外と比較すると医薬品の開発コストやスピードの面で課題が残されており、今後更に発展すると思われるグローバル試験に参加していくためには課題の解決が求められます。
課題解決の可能性がある1つとして今回は「セントラルIRB」についてご紹介をしていきます。
 のりす
のりす 治験業界でかれこれ10年以上働いています。Twitterでのフォロワー数は4,000人程。今回も分かりやすさを重視して解説をしていきます
セントラルIRBとは?

セントラルIRBとは、複数の施設の治験審査委員会の審議を一括で取りまとめる治験審査委員会の形態のことです。セントラルIRBでの審議とすることで、手続きの迅速化、さらには医薬品開発の迅速化に繋がることが期待されています。
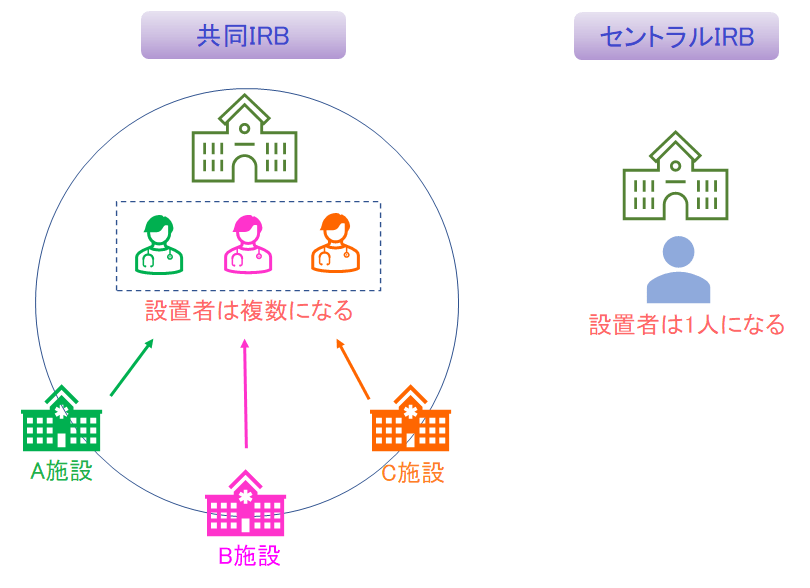
セントラルIRBの他に「共同IRB」というものがありますが、これは別物でセントラルIRBは他の医療機関の長からの依頼により審議できるIRBである一方、共同IRBは複数の医療機関の長が共同で設置するIRBのことを指しています。
つまり、セントラルIRBの設置者は治験実施施設の方とは異なりますが、共同IRBの場合は治験実施施設の長も共同設置者になっているという違いがあります。
治験を新たに始める時や治験関連の変更事項(治験実施計画書の改訂や治験責任医師/の交代等)がある時には治験審査委員会(IRB:Institutional Review Board)で審議され承認される必要があります。
大学病院などは自施設で治験審査委員会を持っていることが多く、例えば10施設の大学病院で治験をやる場合には、10個の治験審査委員会で審議してもらっているということが多いのが現状です。
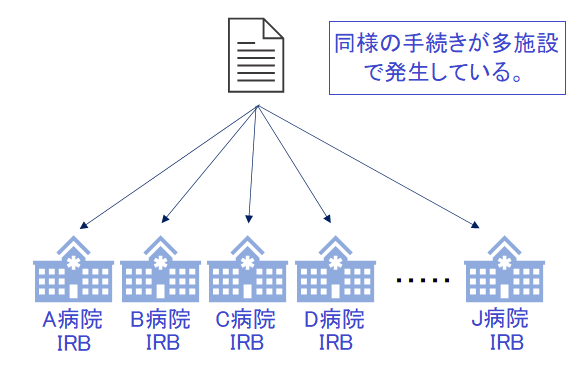
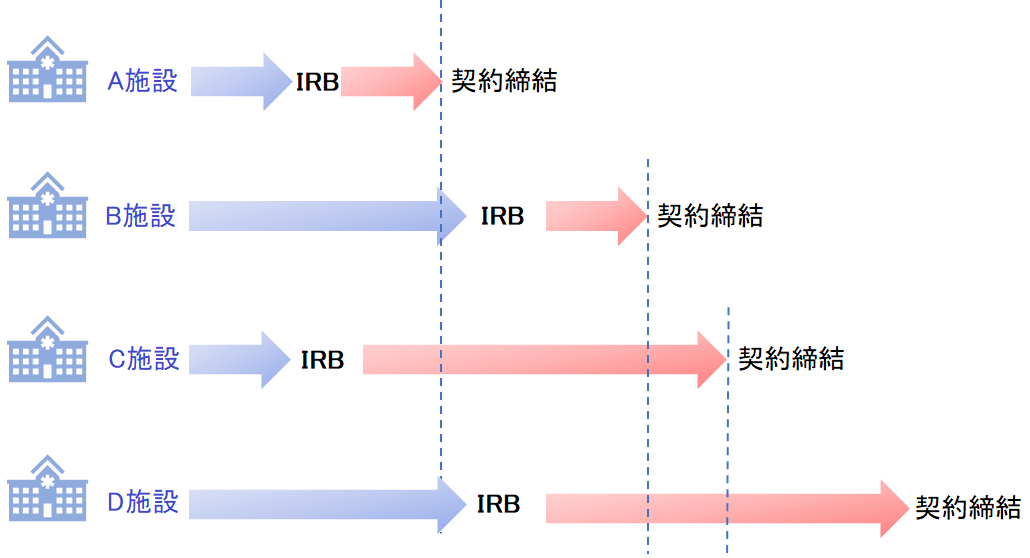
そのため、手続き的な手間も大きく更にはIRB毎に審議できるタイミングや厳しさも違うため、治験開始時期にもバラツキが出てしまうこともあります。
そこで登場するのがセントラルIRBです。
セントラルIRBを活用することで、治験実施施設の治験審査委員会を一括で対応することができるので、手続きの効率化や早期の治験開始に期待することができます。
ただ、セントラルIRB導入までには様々な壁が立ち塞がっていたりするのですよね…
セントラルIRB導入の現状

旧GCPでは、治験実施医療機関毎にIRBを設置することが求められていたのでクリニックが治験に参加することは非常にハードルが高いことでした。
しかし、1998年4月からの新GCPでは施設毎のIRBの設置は廃止され、自施設以外のIRBでも審議が行えるようになりました。
これを機にクリニックでもセントラルIRBを利用して治験に参加できるようになったため、今ではクリニックでも治験実施施設となるケースはかなり増えてきました。
このような歴史を辿って、旧GCP時代からIRBを持っていた大学病院等はそのまま継続して自施設のIRBを使用していることが多く、クリニックは大半がセントラルIRBという構図になっていきました。
 のりす
のりす ちなみに、みなさんは日本にIRBがいくつあるか知っていますか!?2023/2/28現在で全国に1287もあるんですよ!!しかも、年々増加傾向!!詳しく知りたいかたはPMDAのHPで見られます。
2012年3月には文部科学省・厚生労働省から「臨床研究・治験活性化5か年計画2012」が掲げられ日本の治験での症例集積性の向上を目標に掲げて治験ネットワークの促進について言及されました。
その一環として示されたのが、「共同IRB等の活用」になります。
しかし、岡山大学の成本らの「我が国における治験審査委員会(IRB)の状況調査」では施設内IRBの数が約75%を占めていることが報告されており、未だに共同IRBやセントラルIRBよりも施設内IRBの方がメジャーであることが伺えます。
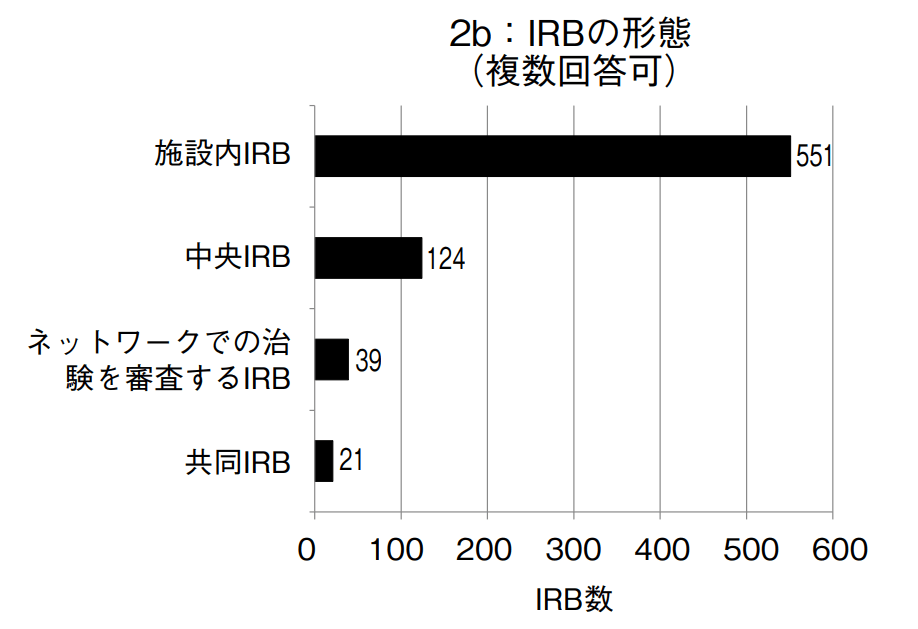 出典:「我が国における治験審査員会(IRB)の状況調査」より
出典:「我が国における治験審査員会(IRB)の状況調査」より
データは2012年4月に実施したアンケートを周回したのものなので、そこから10年が経過していますが今も傾向はあまり大きくは変化していないのではないかと思っています。
自施設にIRBを持っている施設が、セントラルIRBへ移行するためには当然施設側の意識次第というところなのですが実際に事務局の方からのお話を聞いたり講習会でのお話を聞く感じ以下のような理由でセントラルIRB化を進めていない印象を受けました。
●適切に審査できる能力があるか疑問
●たいして症例集積性の貢献に繋がらないと思う
●セントラルIRB導入の手順等の改訂手続きが困難
●治験の状況把握がし難い
また、依頼者側の意見ではセントラルIRB導入に関してはポジティブな意見が大半を占めている印象です(少なくとも私の周りではネガティブな意見は皆無に等しいです)。
私もセントラルIRBにはポジティブな印象を持っていますが、その理由は施設のIRBに対して以下のような印象を持っているためです(あくまで私の感想です)。
●とりあず「修正のうえ承認」としてくる施設がある。
●ICFの修正等で非常に細かい修正など本質的なことが審査いただけてないと感じることがある。
もちろん全てのIRBについて言っているわけではありません。
ただ、大学病院ごとのICF作成時のルールがバラバラでCRAがICFを施設版にカスタマイズしなければいけず、かなり大変な思いを何度もしたことがあります(ICFの統一化についても界隈ではよく議論されていますよね)。
CRCさんからも丁寧にレビューをされていてかなり大変だというお話を聞いたこともあります。
これが全施設共通の1つのICFをセントラルIRBで審査すればOKということになれば、どれほど効率的かと思うCRA/CRCさんもいるのではないでしょうか?
 のりす
のりす 私は自施設のIRBとセントラルIRBの両方での対応を経験したことがありますが、セントラルIRBでの対応の方が圧倒的に負担が少なかったです。
ただ、セントラルIRBの場合はPIではなく依頼者側(主にCRO)が説明しなければいけないことが多く、発表前は緊張でお腹が痛くなることもありましたが…!
ICFの統一化は負担軽減だけではなく、同じ試験に参加する被験者さんに同じ情報を提供するという公平性の観点でも健全ではないかと思います。
また、IRBの予定が詰まっていて新規の審査に関しては数か月待ちという施設も中にはあります。
IRBが遅れるということは治験のスタートも遅れるということですので、治験の効率化という観点ではやはりセントラルIRBの導入が必須なのではないかと考えています。
海外のIRBの状況

セントラルIRBの普及がまだまだな日本ですが、では欧米はどうなのでしょうか。
欧米の様子も少し覗いてみましょう。
米国のIRB
米国ではCommon Rule(省庁間共通の規則)に多施設共同研究においての単一IRB審査が義務付けられ2020年1月20日より適用されています。
§__.114 Cooperative Research
(中略)
(b)(1) Any institution located in the United States that is engaged in cooperative research must rely upon approval by a single IRB for that portion of the research that is conducted in the United States. The reviewing IRB will be identified by the Federal department or agency supporting or conducting the research or proposed by the lead institution subject to the acceptance of the Federal department or agency supporting the research.
また、米国では民間で設立されているIRBが多く信頼性向上のために研究保護計画認証協会(the Association for the Accreditation of Human Research Protection Programs:AAHRPP)やアジア西太平洋地域倫理審査委員会フォーラム(Forum of Ethical Review Committee in Asia and West-Pasific:FERCAP)による認証を得ているIRBが多数あります。
独立した単一IRBでの審議は、「must be independent」の考え方、つまり「自施設のIRBで審議されてどこまで独立性が保たれているの?結構微妙じゃない?だから独立の単一IRBの方が良いのでは?」というような考え方も含まれています。
もちろん、単一IRBでの審議の対象外もあったりしますけどね。
EUのIRB
EUでは、2001年5月から施行されているEU臨床試験指令(EU Clinical Trial Directive)で、複数の加盟国において実施される多施設共同試験では加盟国毎に1つの意見を取りまとめるように規定がされています。
いわゆる、一国一意見の原則が求められているので単一IRBで審議されるということですね。
米国では義務化が2020年からであったため、EUは最も早く単一IRBを義務化していたことになります(だと思います…恐らく…)。
日本では皆さんご存知の通り、「義務」ではなく「許容」という位置付けになっていますよね。
 のりす
のりす 欧米諸国でセントラルIRBが義務化されている影響か、日本が参加しているグローバル試験ではセントラルIRBでの審議を日本でも必須とする試験も出てきており、国際共同治験の拡大に相関して今後もセントラルIRBを必須とする試験が増えてくるかもしれませんね。
このように欧米諸国ではセントラルIRBが義務化されている一方で、日本では義務化されていないため普及にも差が出ているのでしょうね。
また、欧米のみならず韓国でも公的なセントラルIRBが設置されている等、世界的に見てもIRBのセントラル化の流れが進んでいる状況です。
セントラルIRBへの最新トレンド導入

セントラルIRBに関しては、「試験実施の円滑化」という観点で語られることが多いのですが、実は今の業界の最新トレンドの導入も見込めるのではないかと考えています。
ここからは依頼者視点として私の戯言をお話させていただきます。
Fair Market Valueの導入
治験におけるFMV(Fair Market Value:市場適正価格)は、製薬協の「治験における医療機関費用の適正化に関する検討」でも触れられていますが、治験でかかる費用の適性化について考える時によく出てくる考え方です。
施設から請求される費用を見てみると、中にはその算定根拠がはっきりしないものもあり、「他の依頼者さんにも払ってもらっていますので」や「こんなことを聞いてくるのは御社だけですが?」というようなフレーズは私も結構聞いてきました。
他のCROや依頼者のみなさんはどうですか?
また、同じ試験であっても施設によって症例単価が大きく異なることがあり、HQ(Head Quarters)から説明を求められる経験をしたこともあります。
かつては、施設に言われるがままに費用を支払ってきた製薬メーカーですが、昨今では国際共同治験の件数も増えてきており不透明な費用算定については是正が求められています。
同一試験において、多施設間で費用の大きなバラつきがある場合に特に問題となるわけですが、セントラルIRBによって全施設統一した費用算定で審議を依頼できるのであれば、費用の透明性・妥当性の観点からも健全だと言えるのでは?と考えています。
Patient Centricityを意識した審議
日本ではICH E8(R1)が2022年12月23日にSTEP5に到達し、「「臨床試験の一般指針」の改正について」の「2.3 医薬品開発への患者からの情報の反映」の項にPatient Centricityの考え方が追記されました。
すごく簡単に言えば、「医薬品開発をする上で患者さんの視点の考え方も取り入れましょう」というものですね。
そして、Patient Centricityの一環として患者さんからのレビューが多い資料としてICFが挙げられます。ICFは患者さんの手に渡る物ですので、「患者さん視点」が特に重要だと言えますよね。
Patient Centricityは今後拡大していくだろうとは思いますが、ICH E8(R1)がリリースされてから時間も経っておらず、まだ過渡期かと思います。
そこで、もしセントラルIRBで患者目線から審議していただければ(主に非専門家のタスクになるかと思いますが)、Patient Centricityの拡大に寄与することになり更にはより良い治験環境の整備に繋がるのではないかと考えています。
ただ…そうなると、ICFの修正指示が出る可能性が高くなり一発承認がレアケースになり兼ねず試験の円滑化・迅速化という観点からは相反してしまうので賢い仕組み作りが必要そうです。
その他、IRB審議の状況を動画配信することで一般の方々への透明性を確保するというのも面白そうです(機密情報の漏洩のコントロールが必要そうですが)。
ChatGPTの活用
昨今、世間を賑わせているOpneAI社が提供しているChatGPTなどのAIを活用してIRBの議事録作成などの業務効率化を図れるのではないかと考えました。
また議事録のみならず、先ほど少しお話をした動画配信においても同時翻訳機能を使用することでグローバル試験であっても海外の担当者もIRBの様子を見ることができるような仕組みを構築することもできるかもしれません。
セントラルIRBでハイレベルな本質的な質疑応答になった際にも、グローバルの担当者から直接説明できる機会があれば双方にとってメリットがあると考えられます。
その他、施設側のセントラルIRBに対する懸念点として「自施設の実施体制等を加味して審議されるか疑問」という声がそれなりにあるかと思います。
この点に関しても、例えば運用に関するいくつかの質問に施設に回答してもらいその内容をAIに学習させることで施設運用を加味した審議も可能になるのではないかと妄想しています。
更に言えば、過去の審議資料等(例えば議事録等)を読み込ませることで、同様の懸念点がある審議事項について抽出することも可能となり、重大な部分での「見落としリスク」の逓減にも繋がるのではないでしょうか。
まとめ
セントラルIRBの導入に関して施設側では依然として反対意見も数多くあります。
その原因は多岐に渡りますが、セントラルIRBの普及にはその原因を1つ1つ丁寧に解決していかなければいけないのかなという印象を持っています。
例えば、「適切に審議できるのか」という疑問に対しては実際に議論された内容を施設に見てもらい納得してもらう必要があるでしょう(そういう意味では先ほどの「動画配信」で見てもらうという手もありそうですよね)。
導入の手続きやSOP作成が困難という意見に関しては、ChantGPTの活用でより効率的に進めることが期待されるでしょう。
施設収入の減少に関しては、将来的にセントラルIRBの使用を必須とする試験が増えれば結局収入減少に繋がってしまうため、セントラルIRBでの体制構築を今のうちに進めておくことは将来的な施設の収入確保に繋がるでしょう。
症例集積性に関しては、ICFの審議をPatient Centricityを踏まえて行うことで患者目線が織り込まれ、倫理的な完成度が上がるのみならず同意取得率の向上に寄与する可能性もあるでしょう。
その他、セントラルIRB導入によって施設側にとっても受託件数の増加が見込めたり収益面においてもプラスになることも想定できます(こちらはセントラルIRBを導入した施設に協力してもらい実績を提示する論文を書くなども効果ありかも?)。
このようにセントラルIRBは施設から切り離されているからこそ先進的な挑戦をしやすい側面もあるかと思うので、今後の日本の医薬品開発の発展のために更に普及していくことを祈っています。
日本で行われている治験は高品質ではあるものの、コスト面やスピードの観点から海外にまだまだ遅れを取っている状況です。 その課題を解決するための1つの手段として以前より注目されているのがセントラルIRBによる一括審議です。 …


がついに始動!.jpg)






“【基礎から解説】医薬品開発の迅速化に貢献するセントラルIRBとは?” への1件のフィードバック