
令和4年8月31日には薬機法の経過措置期間が終了し、9月1日からは完全移行となります。しかし、現時点では導入の実例報告も少なく、9月1日の完全移行を前にして業界内でも困惑の声を聞く機会があります。
そこで、早期段階より治験使用機器を定義した運用を開始したので情報共有という目的で本記事を執筆してみました。
はじめに
私のチームでは、早期の段階(2021年夏頃)から治験使用機器を定義したプロトコル作成を行い運用をスタートしています。
しかし、「治験使用薬」や「治験使用機器」は新たな定義としてGCPに加わったため、実例紹介や注意すべき点の情報があまり無い状況ですが、実際に運用をしてみたところ色々と注意すべき点が見えてきました。
このような大きな運用の変化がある段階では、業界の皆さんが手探りの中、最適な方法を探っていくこととなるかと思いますが、先陣を切って進んだことで考えたこと、注意した方が良いと思ったことを共有することで業界に少しでも貢献したいという願いを込めて本記事を執筆することにしました。
本記事の執筆以降、完全移行前までにはQ&A等で明確な指針が示されることと思いますが、私が経験した導入実例について紹介をしていきたいと思います。
なお、本記事は個人ブログですので、所属する会社の考え等ではなく、実際に対応をして個人として感じたこと、注目すべきことだと感じた点のまとめということをご了承下さい。
また、本記事は、医薬品治験における治験使用機器の位置付けを想定して記載していますので、その点もお気を付け下さい。
また、本記事を読み進めていく上で、なんとなくのイメージを持っていただきながら読んでいただく方が理解が深まるかもしれません。
医薬品の治験で治験使用機器を設定する場合は、以下のパターン1のように評価項目の測定機器を治験使用機器にするパターンや、パターン2のように評価をする上で重要な役割を果たす医療機器を治験使用機器にするパターン等が考えられるかと思います。
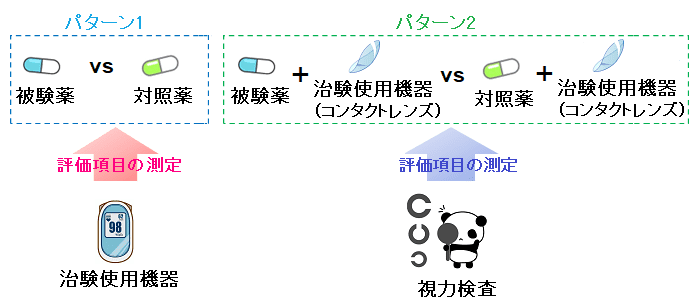
「そもそも治験使用薬や治験使用機器が追加となった背景がよく分からない!」という方は以下の記事で詳細にご紹介しているので、ご覧下さい。
令和2年8月31日に医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律が改正となり、それに伴いGCP省令も改正されました。 改正されたGCP省令には新たに「治験使用薬」という文言の定義が加わりましたが、GCP改正直後ということもあり、治験使用薬が新たに定義された経緯やそれがどのような薬剤を指すのかが今一ピンとこないという方も多いのではないでしょうか。 今回は、そんな治験使用薬について、私が勉強会や各種通知を通して確認した内容をまとめていきたいと思います。
令和2年8月31日に薬機法が改正され、それに伴いGCP省令も改正されました。 前回は、新たに加わった治験使用薬の追加背景や定義について詳細に触れていきましたが、その後、Q&Aなどが更新され、その運用がより具体的になってきました。 今回の記事では、治験使用薬が加わることで主に現場で留意しておく必要がありそうなポイントや今までの運用とどのように変わっていったのかを紹介していきたいと思います。 加えて、令和3年8月施行分の内容についても触れていきますので予め予習をしておくのにもお使いいただければ幸いです。
医薬品治験における治験使用機器とは?
令和2年8月31日に医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(以下、「薬機法」)が改正となり、それに伴いGCP省令も改正されました。
そして、GCP省令が改正されたことを受けて同日にGCPガイダンスが発出されています。この時、新たな定義として追加された用語のうちの1つが「治験使用機器」になります。
医療機器のGCPガイダンスでは治験使用機器は以下のように定義されています。
この省令において「治験使用機器」とは、被験機器(治験に係るものに限る。以下この項において同じ。)並びに被験機器の有効性及び安全性の評価のために使用する機械器具等をいう。
「治験使用機器」とは、被験機器(治験に係るものに限る。)並びに被験機器の有効性及び安全性の評価のために使用する機械器具等をいい、具体的には、治験計画届書及び治験実施計画書において規定された被験機器、対照機器、併用機器等が含まれる。
今回の記事は、医薬品の治験における治験使用機器のお話なので、医薬品のGCPガイダンスの以下の部分も意識する必要があります。
第9項の「治験使用薬」とは、治験において被験薬の有効性及び安全性の評価のために使用する、治験計画届書及び治験実施計画書において規定された既承認有効成分又は未承認有効成分を含む薬物(被験薬を含む。)を意味する。具体的には、被験薬、対照薬、併用薬、レスキュー薬、前投与薬等が該当する。
なお、GCP省令において「治験使用薬」に対して求める事項については、薬物に係る治験において被験薬の有効性及び安全性の評価のために使用する機械器具又は加工細胞に対しても、同様に遵守されることが望ましい。
上記の規定を考慮したうえで、「医薬品治験における治験使用機器の位置付け」を分かりやすく解釈すると以下のようになります。
●治験使用機器は治験届及び治験実施計画書において規定されている機械器具等が該当する。
●医薬品の治験において、治験使用機器は治験使用薬と同様に扱われることが望ましい。
私が医薬品の治験に治験使用機器を設定する際には、この根本を軸にロジックを組み立てていきました。
この軸から更に解釈を広げてプロトコルに落とし込み、そして手順書にも落とし込んでいくわけですが、今の運用ではこの「解釈の広げ方」が各依頼者によってバラつく懸念があり、CROや施設・SMO側が混乱してしまうのではないかと危惧しています。
実際に、プロトコル作成の際にPMDAに相談をしてみましたが、「どこまでの範囲を治験使用機器に設定するかについては、依頼者見解で決めること」というニュアンスであったため、依頼者による解釈の介入余地が多分に残されていることになります(なので、解釈のバラつきを抑えるための製薬協やPMDAからの見解は欲しいところかなと個人的に感じるのです)。
「治験使用機器」と「治験使用機器相当」の違い
本題に入る前に、治験使用機器“相当”についても触れておきましょう。
実は、GCPガイダンスには登場しないのですが、いくつかの通知を見ていくと「治験使用機器相当」というワードに遭遇することがあります。
この“相当”というのは、「手続き上、医薬品の治験なのか医療機器の治験なのかそれとも再生医療等製品の治験なのかを区別するため」に事務的に使用されているワードとのことです。
例えば、ある治験で医薬品薬と同時に医療機器を使用する場合に、医薬品を「治験使用薬」、医療機器を「治験使用機器」と呼んでしまうと、この試験が医薬品の治験なのかそれとも医療機器の治験なのかが分からなくなってしまいます。
ここで、「治験使用薬」と「治験使用機器相当」という使い方をすれば、治験使用機器の方が「相当」と付いているので、メインでは無く、治験使用薬がメインの治験、つまり医薬品の治験であるということが分かるということですね。
そのため、「治験使用機器相当」はGCPでは定義されていませんが、治験届について記載されている通知「治験の依頼をしようとする者による薬物に係る治験の計画の届出等に関する取扱いについて」には、以下のように定義されています。
治験実施計画書において被験薬の有効性及び安全性の評価に使用することを規定された医療機器(以下「治験使用機器相当」という。)及び再生医療等製品(以下「治験使用製品相当」という。)についても、本通知の「治験使用薬」と同様の取扱いとすること。
この通知にしか定義されていないことからも、届出の手続きをする際に必要なワードということが分かるかと思います。
このことからも分かるように、私は「相当」については、手続き上の表現であり、深い意味は無いことから、プロトコルでは「治験使用機器相当」という定義ではなく、「治験使用機器」として定義付けをすることで差し支えないと考えました。
依頼者によっては、プロトコルで「治験使用機器相当」と定義するメーカーもあるかもしれませんが、「治験使用機器」と同じ意味合いで使用しているはずです(定義の文章は「治験使用機器」のものと同じですよね?)。
実際の運用
それでは、実際に医薬品の治験で治験使用機器をどのような位置付けに設定して、どのような運用としたのかを根拠を述べながら紹介をしていこうと思います。
治験使用機器として定義する医療機器
まず始めに直面したのが「どこまでを治験使用機器としようか…」という点です。
治験使用機器の定義から考えると、被験薬の有効性又は安全性の評価に使用することを規定した機器ということですが、以下のポイントに着目する必要があると考えました。
●一般医療機器であっても治験使用機器に該当する。
上記の詳細は、「機械器具等に係る治験の計画の届出及び治験不具合等報告等に関する質疑応答集(Q&A)について」内のQ2とQ7に示されています。
これらを念頭に置き、治験使用機器とするものしないものを分けていきました。
以下には例示を示してみました。
機種等の限定をしていない場合
●血圧計
●体温計
●心電図計
●身長体重計
有効性や安全性の評価に影響を及ぼし、かつ機種等を限定している場合
●パルスオキシメーター
●血糖値測定器
●内視鏡
考え方としては、主要評価項目あるいは副次評価項目として設定している値を測定するために、測定機器を限定した場合や各評価項目に直接的に影響を及ぼす医療機器のうち使用する機器を限定した場合を治験使用機器とする…という感じです。
キーワードは、「限定」という部分で、治験でも一般的にバイタルの測定などがあると思いますが、大半は機種までは指定されておらず、施設にある機器で測定をしているかと思います。
そのような場合には、治験使用機器には該当しません。
もちろん、上の例では血圧計を治験使用機器としない例で書いていますが、仮に降圧剤等、血圧が主要評価項目として設定され、測定する血圧計についても機種が特定されている場合は、治験使用機器になり得るので注意が必要です。
治験使用機器として設定する根拠としては、先ほどもご紹介しましたが、GCPガイダンスの以下の部分となります。
この省令において「治験使用機器」とは、被験機器(治験に係るものに限る。以下この項において同じ。)並びに被験機器の有効性及び安全性の評価のために使用する機械器具等をいう。
「治験使用機器」とは、被験機器(治験に係るものに限る。)並びに被験機器の有効性及び安全性の評価のために使用する機械器具等をいい、具体的には、治験計画届書及び治験実施計画書において規定された被験機器、対照機器、併用機器等が含まれる。
どのように解釈してどこまでを治験使用機器として定義するかは、依頼者によって考え方が異なってくるかと思いますので、注意が必要ですが、個人的には、「プロトコルで機種名や性能を明記することで使用する機器が限定されてくる場合」を治験使用機器の該当ポイントとして考えており、施設へ説明した際も理解が得られていたように思います。
ちなみに、コンサバに考えすぎて治験使用機器を多く設定してしまうと現場の業務量が膨大になりますので、しっかりとした根拠の元適切に決めた方が良いと感じました。
安全性情報
こちらは色々と悩ましいことがありました。
例えば、一般医療機器を治験使用機器として設定した場合にも安全性情報を治験薬並みに収集しなければいけないのか、安全性情報収集のためにどこまで情報収集をすれば良いのか(他社製品であるため、連携が大変)などなど。
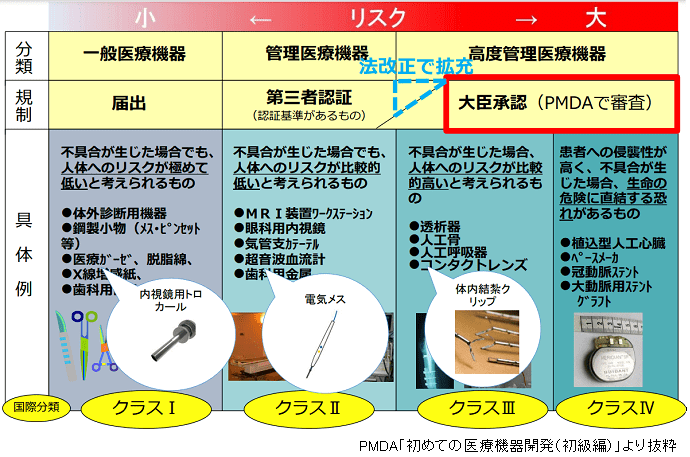 実際には、Q&Aにもあるように一般医療機器であったとしても治験使用機器になり得るということなので、クラスI相当でも安全性情報の収集が必要になるということで、EDCについても安全性情報が収集できる形式で構築をお願いしました。
実際には、Q&Aにもあるように一般医療機器であったとしても治験使用機器になり得るということなので、クラスI相当でも安全性情報の収集が必要になるということで、EDCについても安全性情報が収集できる形式で構築をお願いしました。
また、安全性情報の収集については、医薬品治験の場合も医療機器メーカーと連携することと厚労省の勉強会でお話されていた通り、私のチームでも医療機器メーカーにコントタクトを取って連携をお願いすることにしました。
ですが…先方には治験の経験が無く、どのような安全性情報が必要なのか、そもそも治験での安全性情報の扱いや連携をする必要性など、先方に納得してもらうまでそれなりに時間を割くこととなりました(先方の業務的負荷もあるので、その点も話の折り合いをつけるのに苦労したポイントです)。
皆様、お気を付け下さい…
最終的には、協力してもらえることになり、医療機器メーカーから安全性情報があがってきたら適宜、治験使用薬の安全性情報と併せて治験使用機器の安全性情報も提供する体制とすることができましたが、場合によってはここの協議が難航することも想定でき、我々臨床開発の人間にとっては負荷が大きいポイントとも言えるのではないでしょうか。。
SAE報
また、SAE報については、現在の統一書式では治験使用薬&治験使用機器の両方の情報を網羅できる書式が無いため、書式12と書式14を組み合わせて報告してもらうこととしました。
治験使用機器で収取すべき安全性情報は、医療機器GCPの内容に準拠する項目として、対応方法は以下のマトリックスを作成して構築をしていきました。
| 治験使用機器との因果関係 | |||
| あり | なし | ||
| 治験使用薬との因果関係 | あり |
|
|
| なし |
|
|
|
あくまで、医薬品の治験なので、使用するSAE報のベースは書式12「重篤な有害事象に関する報告書」として、治験使用機器と因果関係があるAEで情報収集が必要な項目については、書式14「重篤な有害事象及び不具合に関する報告書」で対応することとしました。
つまり、あるAEについて、「治験使用薬との因果関係:あり、治験使用機器との因果関係:あり」の場合は、収集しなければいけない情報量がMAXとなり、業務量が増大してしまう恐れがあります。
書式12と書式14で共通する項目については、斜線対応(転記ミスの防止、整合性確認の負荷の低減が目的)とし、書式12と書式14の情報を合わせて治験使用薬及び治験使用機器の情報を集める形です。
2022年2月14日現在、治験使用薬と治験使用機器の情報を一括で収集できるスタイルの統一書式が存在しないため、致し方なく応急的な対応という感じです。
一時期、プロトコルに参考資料として、治験使用薬と治験使用機器の情報を一括で収集できる書式を作成して添付しようかという意見も出ましたが、収集すべき情報の漏れがあるのが嫌なことと、施設側が統一書式の方が受け入れやすいだろうと判断し、現存する統一書式を活用する方法を取りました。
その他、SAEの連絡については、医薬品と同様の扱いですが、医療機器の場合SAEが発生するおそれがある場合もSAE報告対象なので、当然そちらについてもプロトコルに明記することとしました。
不具合情報
不具合の定義は、「治験使用機器についての破損、作動不良等広く品質、安全性、性能等に関する治験使用機器の具合がよくないこと」としました。
これは医療機器の治験の場合と同様かと思うので、何かひねりを加えたものではありません。
ただ、医薬品の治験ということもあり、有害事象なし(SAEのおそれも無し)の不具合については、原資料に記録をすることだけに留め、EDCでの情報収集はしない方針としました。
これは、「治験使用機器について不具合の評価をすることが本試験の目的ではない」と判断したためです。
もちろん、有害事象が伴う不具合についてはEDCでも情報を収集することとしました。
こうすることで、EDCで過分なデータが収集されることを抑えました(コスト的にも収集データが多くなると高くついてしまうので…)。
施設との契約書
施設との契約書についても注意が必要です!
施設の契約書は当然ですが、医薬品の治験で治験使用機器を設定している想定ではないため、契約書の「副作用報告」の項目の記載の修正・加筆が必要です。
医薬品の治験であっても、治験使用機器を設定する以上、SAE報告が付きまとってきますので、治験使用機器のSAE報告について言及しておく必要があります。
私が経験した施設では、全てで契約書に治験使用機器が想定されたSAE報告(不具合報告)の記載がありませんでしたので、施設と契約する際には追記をお願いするようCRAに指示をしました。


油断していると漏れやすいので、医薬品の治験で治験使用機器が設定されている場合にはご注意を!
治験使用機器の性能担保
私が経験した試験では、有効性評価のために治験使用機器を設定したため、性能を担保する資料(第三者が見て妥当であること判断できる資料)を入手することとしました。
これは治験使用機器が設定されてから発生した対応というより、治験使用機器を設定する前から有効性や安全性の評価に重要な位置付けの医療機器に関しては、性能を担保できる資料を入手しているかと思うので、あえての記載は不要だったかともしれませんが、一応書いておきました。
まとめ
今回は治験使用機器についてご紹介をしていきました。
医薬品の治験で治験使用機器を設定するパターンはレアケースかもしれませんが、昨今は治療アプリも登場してきているため、今後はもしかしたら医薬品+治療アプリの組み合わせてでの治験もデザインも出てくるかもしれませんね。
その時は、医薬品の治験であれば治験使用機器(手続き的には治験使用機器相当)、医療機器の治験であれば治験使用薬(手続き的には治験使用薬相当)が出てきますので、今回の考え方が役に立つ時がくるかもしれません。
今はまだ手探り状態で運用を進めていかなければいけませんが、業界内で有意義な情報交換の場があれば私個人としてもとても嬉しいです。








