
CRAやCRCさんであれば必ず直面する有害事象の因果関係判定の確認。
これがまた厄介で、依頼者や先輩によって考え方に差があることもあり、特に新人さんは何が正しいのか混乱してしまう部分かと思います。
今回は根拠資料をしっかりと確認しながら有害事象の因果関係判定について考えていきたいと思います。
有害事象と副作用

私のブログは新人さんにも多く読んでいただいているので、毎度ながら基礎的なお話からスタートしていきたいと思います。
所々難しいところもありますが、なるべく噛み砕いて分かりやすさ重視でお話を進めていきます。
安全性情報の取り扱いについてのガイドライン
臨床試験での安全性情報についての考え方の大元はICH E2Aになりますが、日本では日本版に運用が調整されている「治験中に得られる安全性情報の取り扱いについて(平成7年3月20日 薬審第227号)」のガイドラインに従った考え方がベースになっています。
平成7年のガイドラインなので古めかしさもありますよね。
今回は、このガイドラインとGCPをベースにお話を進めていきたいと思います。
新人さんで「ICHってなに…?」という方はこちらから読んでみても良いかもしれません(後回しでも読んでも本記事は読めるのでご安心を)。
今回の記事では、ICHをまだほとんど読んだことがなく、どこから手を付けたら良いか分からない方向けに、簡単な概要をまとめてみました。 また、2021年7月7日(水)に第43回ICH即時報告会がありましたので、その内容についても簡単に触れています。 “ICHは難しそう”と苦手意識を持っている方や新人の方、またこれから臨床開発の世界で働く予定の方の一助となれば幸いです!
有害事象と副作用の定義
治験で有害事象が発現した時には、治験使用薬との因果関係を治験責任医師または治験分担医師が評価することになります。
治験責任医師や治験分担医師の判断で有害事象が治験使用薬以外の原因で起こった判断されればただの有害事象でそれ以外は副作用になります。
GCPガイダンスの説明も一応載せておきますね(GCP本文の定義よりもガイダンスの方が分かりやすいのでそちらを掲載します)。
「有害事象」とは、治験使用薬又は製造販売後臨床試験使用薬を投与された被験者に生じた全ての好ましくない又は意図しない疾病又はその徴候(臨床検査値の異常を含む。)をいい、当該治験使用薬又は当該製造販売後臨床試験使用薬との因果関係の有無は問わない。
「副作用」とは、投与量にかかわらず、投与された治験使用薬に対するあらゆる有害で意図しない反応(臨床検査値の異常を含む。)。すなわち、当該治験使用薬と有害事象との間の因果関係について、少なくとも合理的な可能性があり、因果関係を否定できない反応を指す。
文章だけだと分かりにくいと思うので簡単に図で表すと以下のようになります。
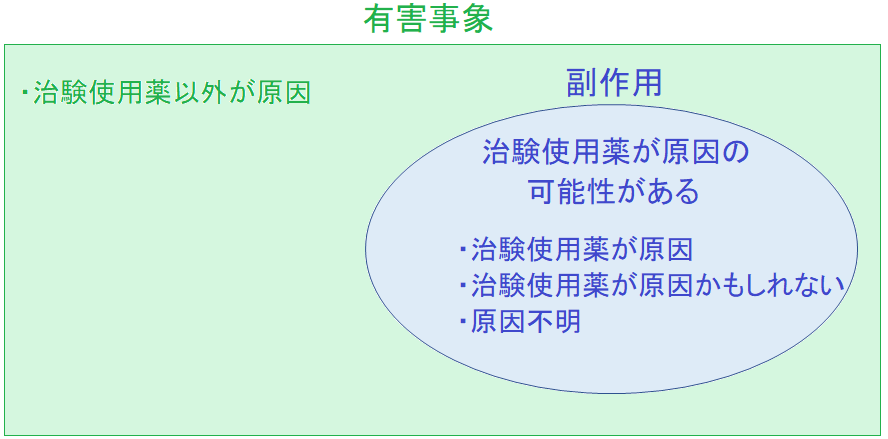
つまり、治験使用薬が原因である可能性があるのであれば副作用としてみなされることになるので結構厳しめな決まりとも言えますね。
「うーん、治験薬使用薬が原因かどうかはよく分からないね~」というような医師判断であれば原因不明なので副作用として扱われることになります。
では次に日本のE2Aガイドラインである「治験中に得られる安全性情報の取り扱いについて」の記載を見てみましょう。
(2)副作用(Adverse Drug Reaction)
病気の予防,診断もしくは治療,または生理機能を変える目的で投与された(投与量にかかわらない)医薬品に対する反応のうち,有害で意図しないもの。医薬品に対する反応とは,有害事象のうち当該医薬品との因果関係が否定できないものを言う。
GCPには、「少なくとも合理的な可能性があり~」という表現が登場しますが、ガイドラインには「合理的な~」という表現は登場していないことが分かりますね。
この辺りのお話はあとで登場するので、この時点では「ふーん」くらいに思っておいていただければOKです。
治験責任医師/分担医師への因果関係の確認

有害事象が発現したら治験責任医師や治験分担医師に因果関係の判断を確認する必要があります。
確認フローを簡略化すると以下のようなイメージです。
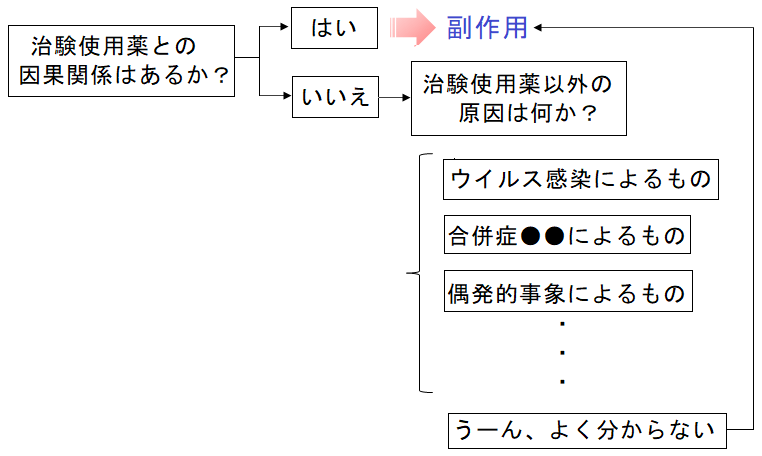
日本のガイドラインでは副作用の定義の中の「因果関係を否定できない反応」に着目した記載のされ方がしています。
なので、上記のように治験使用薬との因果関係が無いと判断された時には、「なぜ無いと判断するのか」を事細かく聞いているのですよね。
かつては、この考え方で進めていても何も不都合はなかったのですが、近年は日本でも国際共同治験の件数が増えてきており、そう単純にはいかなくなってきました。
先ほど、あえて「日本のガイドラインでは」と強調しましたが、その意味について触れていこうと思います。
有害事象の因果関係の考え方については、先ほども登場したICH E2Aに記載がされています。
このICH E2Aを元にして、日米欧が各国の薬事規制などを考慮した上でガイドラインが出されています。先ほどは日本のガイドラインについてお話をしましたね。
つまり、米国と欧州にもそれぞれにガイドラインが存在しています。
そして、日米欧に存在するガイドライン内で因果関係の考え方に差異がある…
それは何故か…
日米欧で「因果関係」に対する考え方の違い
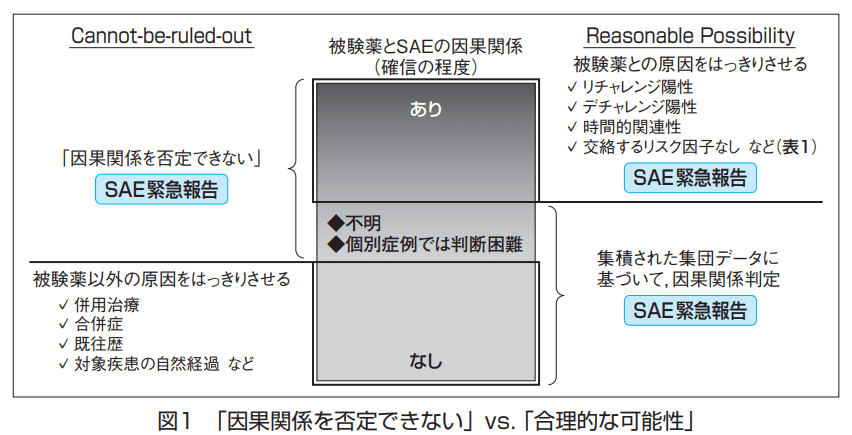
ICH E2Aでは、「合理的な可能性(Reasonable Possibility)」による因果関係判定と、「因果関係を否定できないこと(Causal Relationship Cannot Be Ruled Out)」による因果関係判定という2つの考え方が記載されています。
The phrase “responses to a medicinal products” means that a causal relationship between a medicinal product and an adverse event is at least a reasonable possibility, i.e., the relationship cannot be ruled out.
ICH E2Aより抜粋
Many terms and scales are in use to describe the degree of causality (attributability) between a medicinal product and an event, such as certainly, definitely, probably, possibly or likely related or not related.
Phrases such as “plausible relationship,” “suspected causality,” or “causal relationship cannot be ruled out” are also invoked to describe cause and effect.
ICH E2Aより抜粋
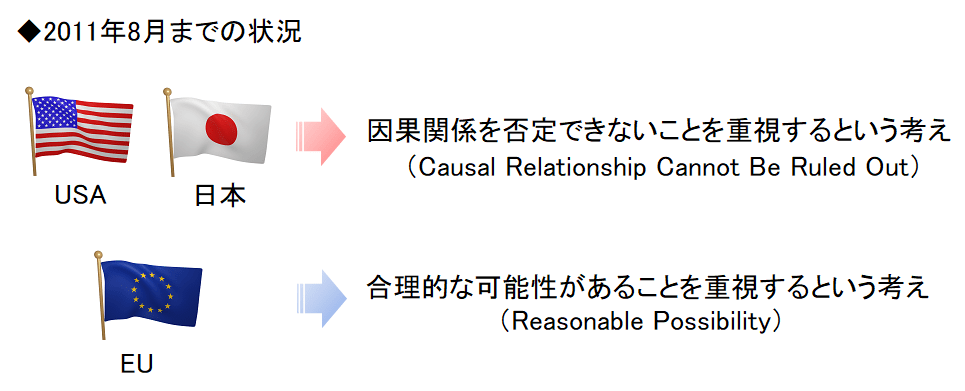
そのため、因果関係を判定する時に「合理的な可能性があることを重視するという考え」と「因果関係を否定できないことを重視するという考え」に分かれることになってしまいました。
 のりす
のりす 作った当初は「2つの考え方」という認識は無かったかもしれないけど、「この考え方って別物だよね」となってしまったというイメージですかね。
 のりす
のりす ICHは認識を統一するためのものですがこれでは…
最初は日米は「因果関係を否定できないことを重視するという考え」という考えで、欧州のみ「合理的な可能性があることを重視するという考え」でした。最初はね…
そして、ICH E2Aが作成された1994年から時が経ち2011年に大きな動きがありました。
なんと…
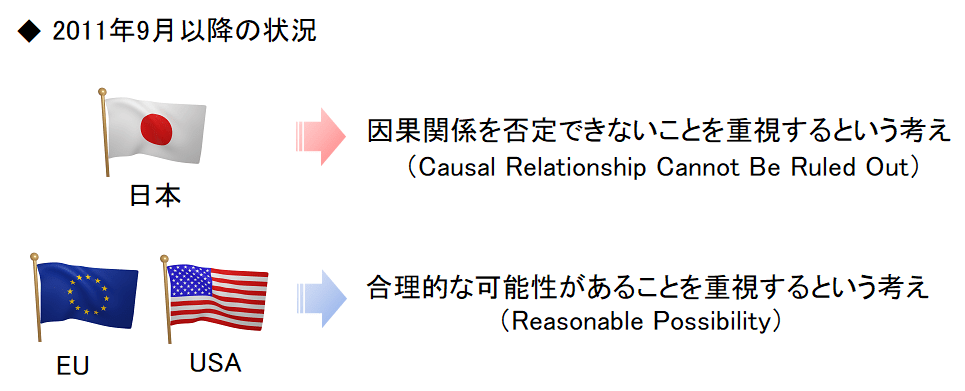
米国で21 CFR Part 312(連邦規則集:Code of Federal Regulations)が改訂され、2011年9月から欧州と同じスタンスである「合理的な可能性があることを重視するという考え」に方向転換をしてしまったんですよね。
 のりす
のりす 日本だけ取り残されたぜよ
米国はなぜ方向転換をしたのか?
「因果関係を否定できないことを重視するという考え」は、つまり治験使用薬との因果関係についてさほど確信度が高くないものまで含まれるため、因果関係を判定する上ではノイズが含まれてしまっている状態になっています。
有害事象「便秘」が発現した。多分、治験使用薬が原因ではないと思うけど、治験使用薬以外にこれといった原因は思い浮かばない。なので、これは因果関係ありで副作用として報告しよう。
⇒このように報告された有害事象は果たして本当に治験使用薬と因果関係はあるのでしょうか?
製薬会社はその試験で組み入れられた被験者全体の情報を持っているため、単独ではノイズと思うような情報も全体で見てみると何かしらの傾向が見られるということもあるかもしれません。
一方で、「合理的な可能性があることを重視するという考え」の場合は、治験使用薬との関連性に対して確信度が高くなりますので、ノイズが少なくなる傾向にあります。
こんな感じですね。
「続編:くすりと有害事象の因果関係」より抜粋
米国は、「因果関係を否定できないこと(Causal Relationship Cannot Be Ruled Out)を重視する考え」ではこのようにノイズが入ってしまい分析に影響が出てしまうため、「合理的な可能性(Reasonable Possibility)を重視する考え」の方が適切だと考えを改めたわけですね。
このように日本と米国・欧州とは有害事象の因果関係に対する考え方が違うわけですが、近年ではこの考え方に違いが現場レベルでも歪みを生んできてしまっています。
近年の日本では、国際共同治験の割合が増えており、2020年では日本で行われている治験の57%にも達しています。
その影響もあり、プロトコルで規定されている有害事象の因果関係の考え方も欧米式が増えてきている状況です。
そのため、欧米式の因果関係の確認方法のみしかし知らない先輩CRAも出てきている可能性もあり、新人さんが「座学で習った事と違う!」ということや「前の先輩と言ってることが違う!どちらを信じたら良いのか分からない!」という状況になることもあるかもしれません。
有害事象の因果関係の考え方に日米欧で違いがあるということを知っておかないと混乱することもあるので、そこを知っておくだけでも随分と違うと思います。
因果関係の合理的な可能性を示すための基準

因果関係の合理的な可能性を示すための基準については、「続編:くすりと有害事象の因果関係」にとても分かりやすく紹介されているのでおすすめです(小宮山さんの資料はどれも面白くて分かりやすいので他の資料もおすすめです!)。
新人のみなさんは、自分が担当する試験の有害事象の因果関係の考え方が「日本式(「因果関係を否定できないことを重視する考え:Cannot be ruled out」)」なのか、それとも「欧米式(合理的な可能性を重視する考え:Reasonable Possibility)」なのかをプロトコルを読んで確認しておきましょう。
その上で、医師に有害事象の因果関係についての問い合わせをする時には何に重点を置いて確認するかをイメージしておくことが重要です。
もしかすると、先輩が「あなたの有害事象の因果関係に対する考え方が間違っている」と指摘してくることもあるかもしれませんが、2つの考え方があるので皆さんの考え方が必ずしもNGというわけではないこともあります。
そのような時は心の中で「因果関係に関する考え方は2つあるからな…この先輩はそれを知らないのかな…」と思いながらやり過ごしましょう。
まとめ
今回は有害事象の因果関係についてお話をしていきました。
日本でも2016年にJCOG試験(国立がん研究センターなどが所属している)の「JCOG 試験における有害事象の因果関係の定義に関するメモランダム」において合理的な可能性(Reasonable Possibility)を重視する判断とすることが発表されています。
今後、日本の試験全体としても考え方が改められる日も来るかもしれませんね。
とはいえ、今はまだ2つの考え方が混在する状況です。
CROの場合は、担当する試験によって考え方を柔軟に変えなければいけないこともありますので、どちらの考え方にも対応できるようにしておくとどのプロジェクトにアサインされたとしても困ることは少なくなるかと思います。
始めのうちはプロトコルをどのように読んだら良いのか分からないことだらけだと思いますが、今回ご紹介したようなポイントも確認してみると実力がワンランク上がるのではないでしょうか!



.jpg)



