
サスメドは、本日2021年12月24日に東証マザーズに新規上場したIPO銘柄です。初値は公開価格より6.1%高い1,500円で値が付きました(一時ストップ高の1,900円まで買われる場面も!)。
今回は、DTxという現在の医療分野で特に注目をされているテーマを扱っているサスメドを医薬品開発の現場で働く臨床開発職の目線から企業研究をしてみました。
私の仕事と特に関りが深いDTxプラットフォーム事業を中心に医薬品開発の専門外の方にも分かりやすいよう解説をしていきたいと思います。
サスメドの概要とDTx
サスメド社は2015年7月に「サスメド合同会社」として設立され、2016年2月に株式会社に組織変更され、サスメド株式会社が誕生しました。
その名前の由来は、”ICTの活用で「持続可能な医療」を目指す SUStainable MEDicine“から来ており、医薬品、医療機器に次ぐ第三の治療法として注目されている「デジタル治療(Digital Therapeutics:DTx)」によって「持続可能な医療サービスを社会に提供し続けること」をミッションとしています。
DTxは、スマートフォンやタブレット端末に搭載されている治療用アプリを使用して疾患の管理、予防や治療を行うことであり、スマホやタブレットや医療データの電子化を背景にその存在感が大きくなり、2010年には米国のバイオベンチャー・Welldoc社の2型糖尿病治療補助アプリ「Bluestar」がFDAにより承認されました。
また、日本ではバイオベンチャーであるCureApp社のニコチン依存症治療アプリ「CureApp SC」が2020年にPMDAに承認され同年12月より保険収載となっています。
米国から10年遅れではありますが、日本でも徐々にDTxの開発が着手され始めており、2021年4月からは厚労省による「プログラム医療機器実用化促進パッケージ戦略」によりDTx開発の後押しもされていることから、今後がとても楽しみな業界です(大手製薬メーカーもDTx関連企業と業務提携をしていますよ!)。
サスメドも以下のように様々な大手企業と業務提携契約を締結しており、私がいる製薬業界の臨床開発界隈でも度々話題に挙がっています。
| 2020年5月 | 株式会社スズケンとの資本業務提携契約を締結 |
| 2020年8月 | 住友商事株式会社、日本ケミファ株式会社との資本業務提携契約を締結 |
| 2020年9月 | 沢井製薬株式会社との資本業務提携契約を締結 |
| 2020年10月 | シミック株式会社とデジタル治療の開発支援に関する業務提携契約を締結 |
| 2021年6月 | EPSホールディング株式会社とブロックチェーン技術を活用した治験業務の効率化を目的に業務提携契約を締結 |
| 2020年5月 | 株式会社スズケンとの資本業務提携契約を締結 |
| 2020年8月 | 住友商事株式会社、日本ケミファ株式会社との資本業務提携契約を締結 |
| 2020年9月 | 沢井製薬株式会社との資本業務提携契約を締結 |
| 2020年10月 | シミック株式会社とデジタル治療の開発支援に関する業務提携契約を締結 |
| 2021年6月 | EPSホールディング株式会社とブロックチェーン技術を活用した治験業務の効率化を目的に業務提携契約を締結 |
サスメド社目論見書より一部抜粋
シミックやEPSは、医薬品開発の業界ではない方はもしかするとあまり知らない会社かもしれませんが、医薬品開発の業界ではCRO(Contract Research Organization:開発業務受託機関)というカテゴリーの会社で、内資系CROのトップカンパニーであるため、知名度が非常に高い会社です。
今後医薬品機開発の効率化に向けて、デジタル医療の開発やブロックチェーン技術を活かして普及していこうという心意気がまさに感じ取れる業務提携だなという印象です。
サスメドの事業概要
同社は、治療用アプリ開発を行う「DTxプロダクト事業」、臨床試験システム及び機械学習自動分析システムの機能を備えたデジタル医療プラットフォームを軸とした「DTxプラットフォーム事業」を展開している会社です。
事業概要の全体像は、下図のようになりますが、そのうち、製薬メーカーの臨床開発職である私が深く関わっているのが、DTxプラットフォーム事業の中の「汎用臨床試験システム」に当たる部分です(先ほどの業務提携のお話では、EPSと業務提携をした内容ですね)。
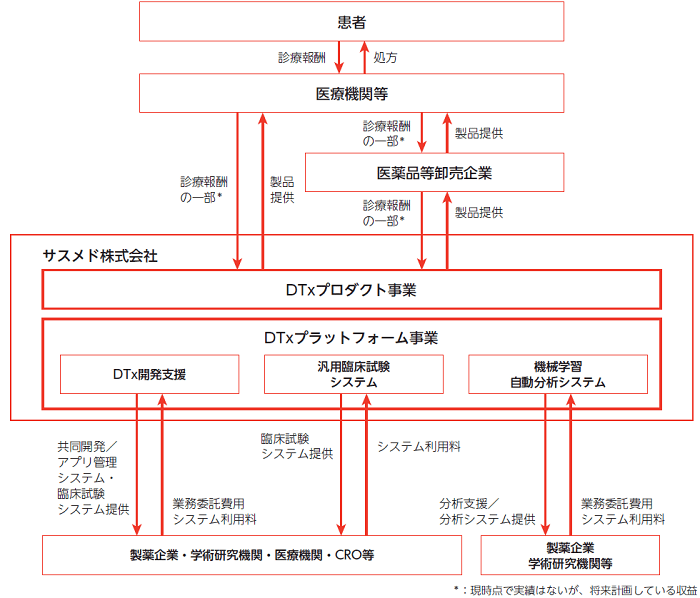
サスメド社目論見書より一部抜粋
今回の記事では、この「汎用臨床試験システム」について現場目線から解説をしていきますが、ひとまず事業全体に占めるDTxプラットフォーム事業の立ち位置を確認するために全体的な事業状況を見てみます。
| 第5期事業年度(2019/7/1~2020/6/30) | 第6期事業年度(2020/7/1~2021/6/30) | |||
| 事業収益 | セグメント損益 | 事業収益 | セグメント損益 | |
| DTxプロダクト事業 | – | ▲56,258千円 | – | ▲160,130千円 |
| DTxプラットフォーム事業 | 34,888千円 | 3,227千円 | 115,489千円 | 8,848千円 |
| (千円) | 第5期事業年度 | 第6期事業年度 | ||
| 事業収益 | セグメント損益 | 事業収益 | セグメント損益 | |
| DTxプロダクト事業 | – | ▲56,258 | – | ▲160,130 |
| DTxプラットフォーム事業 | 34,888 | 3,227 | 115,489 | 8,848 |
サスメド社目論見書より作成
DTxプロダクト事業は、治療用アプリがまだ薬事承認されていないため、研究開発費がコストとして掛かっている状況なので、事業収益はありません。
ただ、不眠症治療アプリが2021年11月に主要評価項目を達成したという段階まで来ているため、この後は薬事承認を取得するために治験の有効性・安全性のデータをまとめてPMDAとのディスカッションとなります。
PMDAと実際に薬事承認についてのやり取りをした身としては、ここが一番大変な山場だと思っていますが、主要評価項目が達成されており安全性に大きな懸念が無いのであれば、薬事承認取得に漕ぎつけることが出来るのでは?と思っています。
特に治療用アプリは、一般的に医薬品よりも安全性面の懸念は少ないと考えられるので、主要評価項目が達成されているのであれば、PMDAからもNGは出ないような気もしています。
もちろん、治験のデータを現段階では見れる訳ではないので、勝算がどれ程あるのかはオープンになっている情報でしか判断できませんが、しかしMade in Japanの医療機器の普及を目指しているPMDAの傾向から考えると、前向きに議論が進むと勝手に推測しています。
薬事承認がされれば、事業収益が入ってくるので、薬事承認されるかされないかは大きな分岐点になりそうですね。
※2023年2月15日追記→サスメドの不眠障害治療用アプリについては、正式に承認されました。了承までの情報は詳しくは以下の記事にまとめてあります。
2022年12月19日に行われた「薬事・食品衛生審議会プログラム医療機器調査会」でサスメドの不眠障害治療アプリの医療機器製造販売承認が了承されました。 株価の動きにも触れながら個人的な着目ポイントをまとめてみたいと思いま …
また、DTxプラットフォーム事業を見てみると、事業収益とセグメント利益が順調に上がってきています。
この後紹介をする「汎用臨床試験システム」の他に、RWD(Real World Data)の「機械学習自動分析システム」もあるため、今後の事業収益の増加にも期待出来ます。
RWDは、医薬品開発の世界では非常にホットな話題なので、私も大いに期待しています。
ちなみに、RWDの市場での評価がどれ程かを判断するためにJMDC(4483)の状況をウォッチしておくと、サスメドの「機械学習自動分析システム」の評価にも役立つと思います。
汎用臨床試験システムの中長期的な経営戦略
まずは、目論見書内に記載されている中長期的な経営戦略から見ていきましょう。
目論見書内では以下のように記載されています。
DTxプラットフォーム事業のうち汎用臨床試験システムでは、サンドボックス制度での研究成果とそれを踏まえたグレーゾーン解消制度での当社の確認に対する厚生労働省からの回答に基づき、臨床試験における実地モニタリングを省略するためのデファクトスタンダートを目指しております。
実地モニタリングの省略に加え、被験者募集プロセスの効率化やデータ欠損の防止による臨床試験品質の向上の観点から、製薬企業や学術研究機関における研究開発コストのさらなる低減をシステム全体で実現してまいります。
サスメド社目論見書より抜粋
現在の製薬業界は、薬価改定により薬価が下げられ、開発コストの削減に関する意識が以前より一層高まっていると痛感しています。
また、治験ではなく一部の臨床研究でもモニタリングが必要になりますが、企業治験程コストを割けないという事情もあり、モニタリングコストの削減が実現できるのであれば、大きなインパクトであることは間違いないでしょう。
そして、モニタリングにおいてサスメドが提供する汎用臨床試験システムが、モニタリングのデファクトスタンダード(目論見書は誤記?)となればサスメドの売上にかなり大きく貢献するはずです。
問題は、デファクトスタンダードになるための実現可能性はどうなのかという点でしょう。
そこで、サスメドが提供する汎用臨床試験システムが一体どんなものなのかについて現場視点を交えながら解説をしていきたいと思います。
ブロックチェーン技術を用いたモニタリング
本記事は、医薬品開発に携わっている方以外の方もご覧いただいているかと思いますので、医薬品開発における「モニタリング」とは何なのかを簡単に紹介をしてから、本題のブロックチェーン技術を用いたモニタリングについて解説をしていきます。
医薬品開発におけるモニタリングとは?
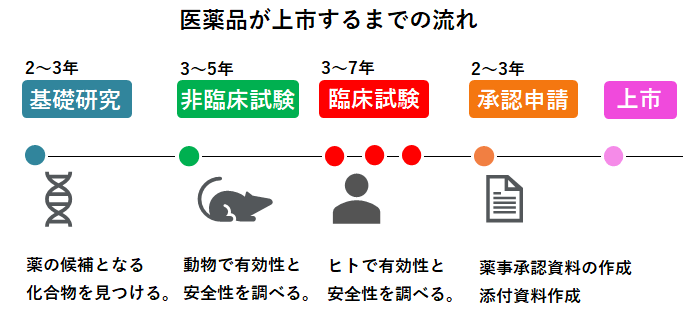
医薬品は、上の絵のように基本的には基礎研究から始まり、非臨床試験と臨床試験により有効性と安全性が証明されれば承認され上市されます。
この流れのうち、臨床試験(ここでは「治験」と同義になります)は、GCP省令で定められているルールに従って行わなければいけません。
そのGCP省令で「モニタリング」については以下のように規定されています。
(モニタリングの実施)
第21条
第21条 治験依頼者は、モニタリングに関する手順書を作成し、当該手順書に従ってモニタリングを実施しなければならない。
2 前項の規定によりモニタリングを実施する場合には、実施医療機関において実地に行わなければならない。ただし、他の方法により十分にモニタリングを実施することができる場合には、この限りではない。(GCPより抜粋)
治験は各医療機関で行われるわけですが、治験実施計画書や手順書や上記のGCP省令に従って行われなければいけません。
そのことを、治験依頼者(ここでは製薬メーカー)のCRA職の方たちが確認をしなければいけなく、このことを「モニタリング」と言います。
モニタリングでは主に以下のようなことを確認していきます。
●治験のために収集されたデータと原資料(電子カルテや検査結果報告書等)に不整合は無いか。
●治験のために収集されたデータは客観的に見て妥当な判断がなされているか。
上記以外にも、もちろん色々あるのですが、主なところは上記3点かと思っています。
そのうち赤字で記載した部分について、サスメドのブロックチェーンを利用したモニタリングを導入すれば省略できるというお話です。
そのため、ブロックチェーン技術を利用してのモニタリングを導入することで、全てのモニタリング業務を省略することが可能ということではない点には注意しなければいけません。
サスメドの目論見書をしっかり見るとそのことにも言及されていますね。
2020年12月には、厚生労働省から当社のブロックチェーンシステムを利用することでモニタリング業務を省略することはGCP省令に違反するものではなく(ただし、データを直接連携・同期していない部分についての一致性の確認まで一概に不要とは言えず、データの一致性の確認以外の業務については引き続き適切に実施する必要がある)…
サスメド社目論見書より抜粋
ちなみに、このモニタリング業務は、製薬メーカーのCRAが行う場合もあるのですが、最近ではCROというカテゴリーの会社に業務委託をしているメーカーが多い状況です。
以下の記事でも少し触れているのですが、CROに業務委託をする際の費用がかなり高額であることから、開発コスト削減という観点からも「モニタリング費用の削減」は注目されています。
日本CRO協会のHPによると、日本CRO協会に所属する協会会員企業の売上高は、2000年では155億円でしたが、2017年には1,927億円と報告されており、CRO市場が拡大を続けてきたことが分かります。 また、2017年~2020年においては、売上高2,000億円を目前にやや頭打ち傾向が見られますが、依然として高い売上高を保っており、多くのメーカーがCROへ業務をアウトソーシングしている現状が伺えます。 そこで、今回は、CROに業務を委託する際の見積もりやBDMの際にどのようなことを考えているのかご紹介をしてきたいと思います。
ブロックチェーンを使うモニタリングとは?
このように、モニタリング業務に対してサスメドのブロックチェーンを利用できる範囲は主に、「治験のために収集されたデータと原資料(電子カルテや検査結果報告書等)に不整合は無いか。」の部分ですので、その部分に絞ってお話をしていきます。
まずは現在の治験でのデータ入力とモニタリングについてです。
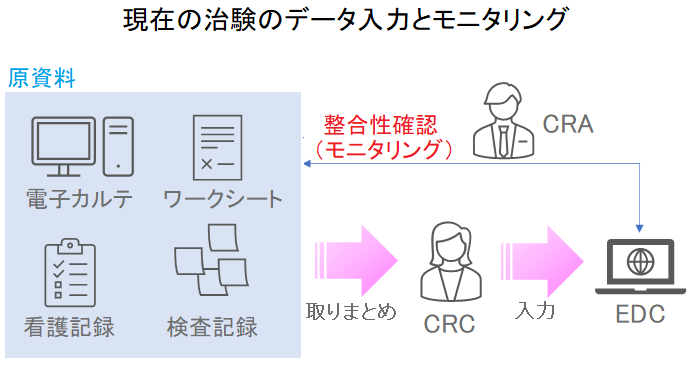
現在は、原資料(電子カルテ、ワークシート、看護記録、検査記録など)にあるデータをCRCさんが取りまとめて、EDC(Electronic Data Capture)と呼ばれる治験のデータを収集するシステムに入力を行います。
EDCに入力された情報は、原資料が元となっているので、CRAはEDCと原資料の整合性をモニタリングによって確認します。
とてもシンプルに流れをご紹介するとこのような感じになります。
次にブロックチェーン(BC)について考えてみます。かなりシンプルにBCを使用しての整合性確認の仕組みについて描いてみると以下のようになります。
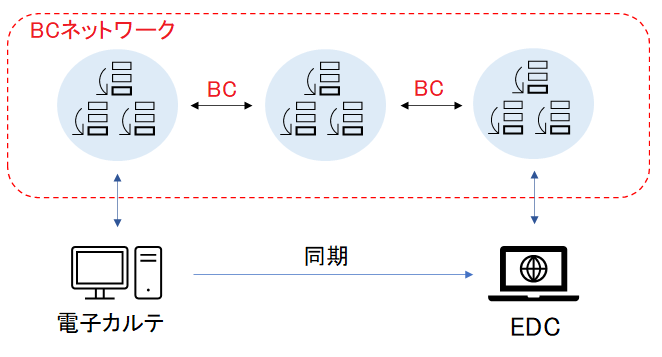
電子カルテ内に治験のデータ収集に必要な項目を入力し、それがEDCと同期。電子カルテとEDCのそれぞれのデータをBCによって整合性確認を行います。
治験の現場では、治験のデータを効率良く集めるためにワークシートという資料が作成されますが、それぞれの資料の整合性確認を行うためには、このワークシートも電子媒体である必要があります。
実際の現場では、ワークシートを紙で作成している施設も多いので、まずは脱紙媒体から進めていかなければいけません。
では、BCを使用した場合、モニタリングの全体像はどのようになるのかを見てみましょう。
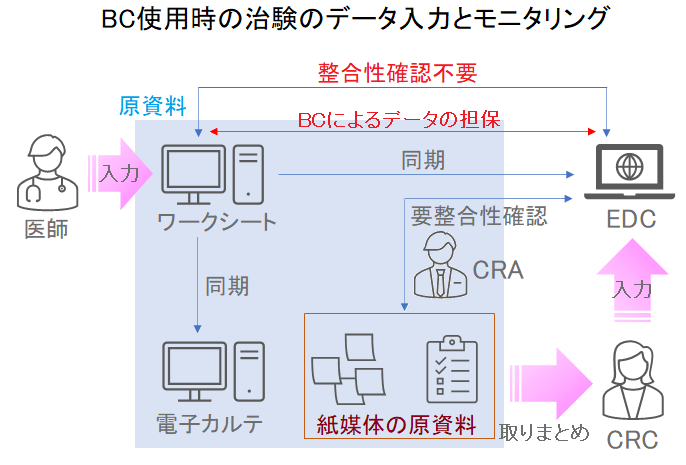
電子媒体として管理されている治験データは、BCにより整合性確認ができるため、CRAによる整合性確認は不要となります。
しかし、看護記録や検査記録などが紙媒体で存在しており、その中の情報をEDCに入力する場合は、BCによる管理が出来ないため、CRAが整合性確認を行う必要があります。
ただ、最近ではほとんどの原資料が電子媒体であることが多いため、紙媒体の確認はあまり無いのでは?というのが体感です。
このことから、ワークシートを電子化し、電子カルテとEDCが同期できる状態であれば、CRCさんによるEDCへの入力も不要になり、それぞれの整合性をブロックチェーンを利用することによって担保しているので、原資料間での不整合を検出できる(つまり、この部分のCRAによる整合性確認は不要となる)ということですね。
ここで知っておきたいのが、「電子カルテとEDCが同期できる状態」にどのくらいの施設が対応しているかという点です。
この辺りは、EDC最大手であるMedidata社などが取り組まれていた記憶があるので、どの程度の進捗率なのかが気になるところです。
あくまで個人的な見解ですが、施設で採用されている電子カルテを変えるということが必要な場合、かなり大変だろうと思っています。
所々課題がありながらも、課題がクリアできればブロックチェーンを利用したスキームで「CRCさんのEDC入力」と「CRAの現地での不整合確認」の作業は大幅に削減することが達成できそうですね!
ブロックチェーンがデファクトスタンダードになったら
もしこのスキームがデファクトスタンダードになれば、開発コストの削減だけには留まらず、実はCRAの働き方も大きく変わりそうだなぁと思っています。
この仕組みであれば、CRAの現地訪問はかなり減るかと思いますので、CRAの仕事が内勤での仕事にウェイトが傾くかと思います。
そうすれば、産休明けで復帰した女性CRAの方が活躍できる可能性が広がるのでは?
CRAは女性の方の割合も多い職種ですし、小さい子どもがいたら外勤が難しいことも多々あると思いますが、内勤業務がメインとなるのであれば、CRAを続けられる方も増えるかもしれません。
…と、少し話が逸れてしまいましたが、ブロックチェーンがモニタリングのデファクトスタンダードになれば、治験のみならず臨床研究でも活用できますので、面白いことになりそうですね。
モニタリングにおけるブロックチェーンの有用性
2021年4月9日のプレスリリースで、サスメドは東京医科歯科大学と「ブロックチェーン技術を用いたモニタリング手法の開発」の実証実験をスタートしていると報告されています。
国立研究開発法人日本医療研究開発機構(AMED)の令和 3 年度 「研究開発推進ネットワーク事業」にも採択されており、業界内でも注目が集まっています。
この実証実験では、東京医科歯科大学で実施される臨床試験において、モニタリングにおけるブロックチェーン技術の有用性の検証や体制、運用などの支援メニューを含め手法を確立することを目指しているとのことですので、結果が楽しみです。
ここで示されている「臨床試験」というのが「企業治験」ということであれば、製薬メーカーでも更に検討が進むのではないかと思います(企業治験なのかどうかは分かりませんが)。
私は製薬メーカーの開発職なので、サスメドから見ると顧客にあたりますが、まずは東京医科歯科大での実証実験の結果や各医療機関における受け入れ態勢を確認したうえで、利用の可否を検討することになるかと思います。
社内規定(SOP)的には、ブロックチェーンを利用してのモニタリングは許容できる範囲なので、あとは施設サイドの受け入れの可否が大きな判断ポイントだと考えています。
本技術をモニタリングに使用することの評判
また、私の周りでもサスメドのブロックチェーン技術を用いたモニタリングのお話になることが時々ありますが、あまり悪い評判は立っておらず、ポジティブに考えている方が多い印象です。
私自身もポジティブに考えています。
医薬品開発全体の課題として、「早さ」、「質」、「コスト」が重要な要素ですので、これらの要素を満たす可能性を秘めているこの技術については期待されているところが大きいのではないでしょうか。
ちなみに、ブロックチェーン技術をモニタリングに応用することについては、CRAのご経験もあるヒロシズさんの記事でも紹介をされています。
私は、サスメドのブロックチェーンについてのお話をメインにしましたが、ヒロシズさんの記事では、アイロムの「aSBo Cloud System」のお話も出てきていますよ。
今後どのようにしてブロックチェーンが広まっていくのかとても注目するところですね!
ヒロシズさんのブログも是非見てみて下さい!
皆さんこんにちは! CRO(ヘルスケア企業)にて新規事業開発をしているヒロシズです。 今回は、先日Twitterでも皆さんに質問した、ブロックチェーン×治験について、元CRA(臨床開発職)の経験と個人的な考察を含めてお話していこうかと思います。 まずはじめに、先日私が皆さんへ質問した、ブロックチェーンの治験への導入によってCRAの働き方はどう変わると思うか?の質問に対する投票結果を貼っておきます。
まとめ
サスメドが提供している「汎用臨床試験システム」である、ブロックチェーンを利用したモニタリングについてを中心にまとめていきました。
今回の技術は、厚生労働大臣及び経済産業大臣からも「法令上、医薬品や医療機器等の臨床試験で求められるモニタリングを、サスメドが保有しているブロックチェーン技術により代替することは認められる」旨の通知を受けているということですので、GCP上問題が無いことが示されています。
また、仕組みも理解しやすいため、製薬メーカー側からの視点でもさほど拒絶されるような仕組みではないと感じています。
残るは施設。
施設側がこの仕組みについて、どのように考えているのか、製薬メーカーの臨床開発職の立場からだと、その辺りのデータを示してもらえると仕組みの受け入れを検討しやすくなるので、今後を楽しみです。
事業内容などをよく知らないとサスメドも”その他バイオベンチャーの1つ”としてしか認識されないこともありそうですが、私から見たら医薬品等を扱うバイオベンチャーとは明らかに毛色が違う銘柄に見えています。
治療アプリの開発は、私たち製薬メーカーの医薬品の開発とは大きく異なり、開発の実現性やコストの見通しも立てやすいことから開発リスクについては新薬を扱うバイオベンチャーと並列で考えるのではなく、別で考えていく必要がありそうですね。
医薬品の開発成功率の低さとコストの高さを考えると、治療アプリの方が堅実という考え方もできるかもしれません(薬事承認の実績が少ないというデメリットはありますけどね)。
治療アプリは、保険点数が付くのでただのアプリとは違い「処方が必要なアプリ」になります。
普通のアプリのようにユーザーが月額費用などを払ってダウンロードして使用するようなアプリではなく、医師からの処方が必要なアプリということで、まだまだ世間の方々には浸透していないかもしれませんが、今後の新しい治療の選択肢のパイオニアとして期待したい会社ですね!
当ブログは、私の個人的な見解を示しているもので、有価証券への投資を勧誘することを目的としておりません。また何らかの保証・約束をするものではありません。投資に関する決定はご自身のご判断にてお願いします。



.png)





“新規上場のサスメドについて治験の観点から評判や仕組みをまとめてみた” への3件のフィードバック