
2023年9月28日付で「医薬品の臨床試験の実施の基準に関する省令の質疑応答集(Q&A)について」が更新されましたが、本記事ではこちらの通知での更新内容について解説をしていきたいと思います。
 のりす
のりす 治験業界でかれこれ10年以上働いています。Twitterでのフォロワー数は4,500人程。今回も分かりやすさを重視して解説をしていきます!
今回の更新の概要
今回厚生労働省から「医薬品の臨床試験の実施の基準に関する省令の質疑応答集(Q&A)について」(以下、「QA集」とします)が更新されて事務連絡が出たわけですが、まずはいつも通り今回の通知の位置付けから見ていきましょう。
細かすぎると混乱をすると思うので、大まかに示していますが以下のようになっています。
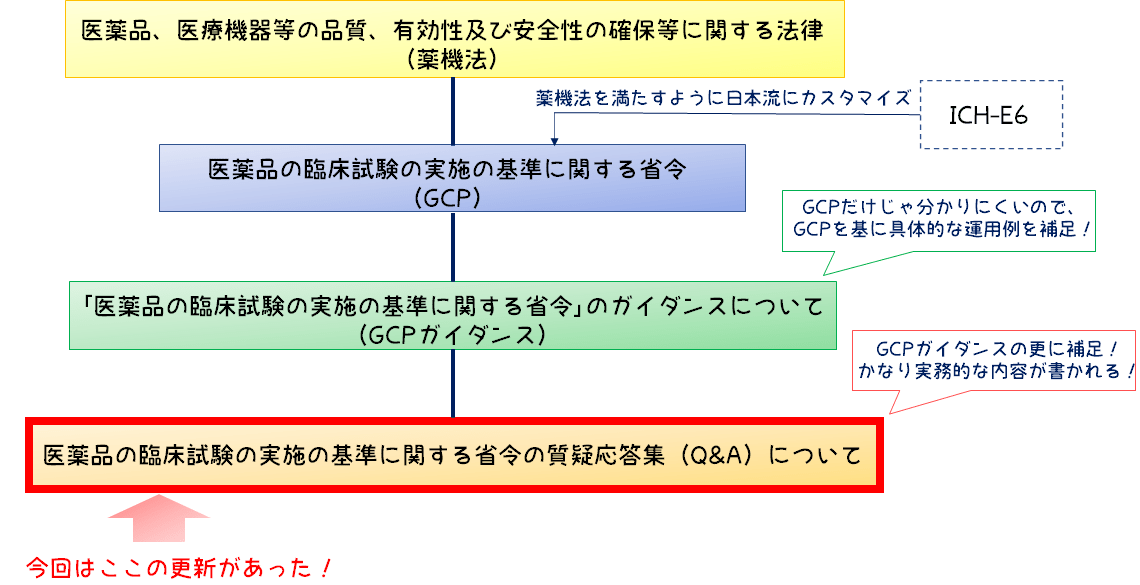
今回更新があったQA集は、GCPガイダンスの補足資料的な位置付けになっている資料になります。
上の図では下に行けば行くほどより実務的な内容が記載されているので、現在出ている通知の中でも最も実務的な内容が記載されている資料が更新されたということですね。
QA集は、令和5年1月31日に発出されていましたが、今回はその時の情報の修正と追加が行われています。
●被験者以外に治験使用薬を交付する際の対応
●試験途中でオンサイトモニタリングが不可になった際の対応
●複写物又は転写物を原資料とする際の対応
●クラウドシステムから電磁的記録を退避させる際の対応
●IRBをオンライン形式で開催する際の対応
今回の記事ではこれらの更新内容について解説をしていきます。
 のりす
のりす ちなみに…今はICH-E6(R3)の更新がされていて近々GCPが大きく改訂することになります(GCPリノベーション)。
そうなると、ガイダンス以下の内容も更新されるものも出てくるので要注意です!
更新内容の解説

令和5年9月28日付の「医薬品の臨床試験の実施の基準に関する省令の質疑応答集(Q&A)について」で更新された内容の詳細について解説をしていきます。
前回のQA集からはQ13以降が追加となりましたので確認をする時にはそちらをメインに確認をされると良いと思います。
治験使用薬を被験者に直接搬送する際の対応
治験使用薬を施設から被験者に直接配送する時には、施設と運搬業者との間でGCP省令第39条の2に基づく契約を締結するか運搬業者の約款で条件を満たしていることを確認する必要があります。
(業務の委託等)
第39条の2実施医療機関(自ら治験を実施する者が治験を実施する場合にあっては、治験責任医師又は実施医療機関。以下この条において同じ。)は、治験の実施に係る業務の一部を委託する場合には、次に掲げる事項を記載した文書により当該業務を受託する者との契約を締結しなければならない。1)当該委託に係る業務の範囲
2)当該委託に係る業務の手順に関する事項
3)前号の手順に基づき当該委託に係る業務が適正かつ円滑に行われているかどうかを実施医療機関が確認することができる旨
4)当該受託者に対する指示に関する事項
5)前号の指示を行った場合において当該措置が講じられたかどうかを実施医療機関が確認することができる旨
6)当該受託者が実施医療機関に対して行う報告に関する事項
7)その他当該委託に係る業務について必要な事項
(業務の委託等)
第39条の2実施医療機関(自ら治験を実施する者が治験を実施する場合にあっては、治験責任医師又は実施医療機関。以下この条において同じ。)は、治験の実施に係る業務の一部を委託する場合には、次に掲げる事項を記載した文書により当該業務を受託する者との契約を締結しなければならない。1)当該委託に係る業務の範囲
2)当該委託に係る業務の手順に関する事項
3)前号の手順に基づき当該委託に係る業務が適正かつ円滑に行われているかどうかを実施医療機関が確認することができる旨
4)当該受託者に対する指示に関する事項
5)前号の指示を行った場合において当該措置が講じられたかどうかを実施医療機関が確認することができる旨
6)当該受託者が実施医療機関に対して行う報告に関する事項
7)その他当該委託に係る業務について必要な事項
GCP第39条の2で掲げられている事項のうち、被験者への直接配送をする時に特に重要なのは「2)当該委託に係る業務の手順に関する事項」で、運搬会社が適切に被験者に直接配送ができる手順を定めているかの確認でしょう。
 のりす
のりす 「配送をした時に被験者がいなかったらどうする?」や「倉庫から被験者の手に渡るまでの温度管理はどうする?」など色々と確認すべきことがありますね。
GCP第39条の2に基づいた契約を締結している場合には問題ないのですが、約款を確認して配送を依頼した場合には「約款を確認した」という担保が必要となってきます。
そこで、今回のQAでは「約款の写し」の施設保管が必要であることが明記されました。
 のりす
のりす 口だけで「約款を確認して依頼しました!」と言っても信憑性に欠けますよね?
なので、どの約款を確認して判断したのか分かるように「約款の写し」を保管しておくようにしたということですね。
CRAさんは、約款を確認して被験者への直接配送を行っている施設を担当している場合には必須文書閲覧の際に約款がしっかりと保管されているかの確認が漏れないように注意が必要です。
約款がどのようなものかよく分からない方は、治験薬配送でも有名なセルートさんの約款を見てみると「こんな感じのものか~」とイメージできるので一度見ておくことをおすすめします。
被験者以外に治験使用薬を交付する際の対応
被験者さんが何かしらのやむを得ない事情で施設に来院できない場合に、家族が代わりに治験使用薬を受け取るにはどのようにしたら良いのかの運用が明記されました。
被験者さんの代わりに家族に治験使用薬を交付する場合には以下の全てを満たす必要があります。
- PI or SI(以下、「PI等」)により、被験者が治験使用薬の投与開始又は投与継続可能と判断されていること。
- PI等により、当該試験の内容(治験使用薬の性質、投与経路及び投与期間など)を踏まえて問題無いと判断されていること。
- PI等により、被験者の状態上、問題無いと判断されていること。
- 被験者から合意が得られていること。
- 被験者が家族から治験使用薬等を確実に受け取れることを家族の署名やその他の手段で確認できること。
- PI等が、治験使用薬の交付等の経緯や対応の記録を保存できること。
これらの条件を全て満たせる場合に被験者さんの家族に治験使用薬を交付することができます。
 のりす
のりす 超えるべきハードルが意外に多くて大変ですね。。
この辺りは、色々な施設での実例を集積してより良い方法を模索していきたいところですよね…
1~5の対応をしっかりと確認できるように6で治験使用薬交付までの経緯や対応を記録して保存することになっていますが、この辺りの記録の残し方は施設によって対応が変わってきそうなのでCRAさんは見落とさないようにしっかりと注意しておきたいところですね。
試験途中でオンサイトモニタリングが不可になった際の対応
パンデミックなどの影響で施設へのCRAの訪問が制限されてしまった場合には、モニタリング計画書を改訂することで代替のモニタリング手法とすることが可能であることが明記されました。
重要なポイントは、代替の方法でモニタリングをした時のリスク評価をしっかりと行うことです。
例えば、オンサイトモニタリングのみの試験で中央モニタリング&リモートモニタリングでのモニタリング方法に切り替えようということであれば、それによって新たに生じるリスクを想定しておく必要があります。
 のりす
のりす 例えば、施設に訪問しなければ見つけることができない逸脱などもありますよね?
その逸脱が被験者さんの安全性や試験の評価に大きな影響を与える場合には相応の対策を講じておく必要があるということですね。
Q&Aでも推奨をされていますが、COVID-19が大流行してからはパンデミック下でCRAが施設訪問できなくなることはリスクとして予め想定しておくべきで、モニタリング計画書やRisk Logに予め入れ込んでおくことが良いかと思います。
 のりす
のりす オンサイトモニタリングを規定していたにも関わらずオンサイトモニタリングができなくなってしまった場合には、できなくなった理由と対応の記録を作成して保存しておく必要があるので注意しましょう!
ちなみに、上記のイレギュラー対応をした時にはCSRの「9.6 データの品質保証」にも書く必要があるかをしっかりと検討することをおすすめします。
複写物又は転写物を原資料とする際の対応
複写物又は転写物を原資料とする場合に、複写物を元の資料の代わりとして置き換えて元の文書は破棄をして良いことが明記されました。
CRA/CRCさんに馴染み深い資料としては血圧や心電図の感熱紙でしょうかね。
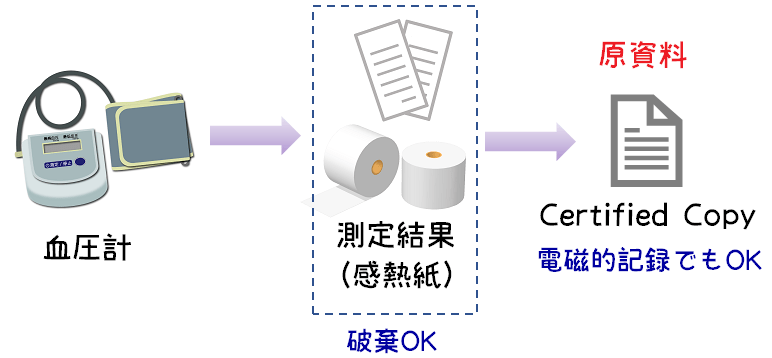
感熱紙のような長期保存に適さない資料については今までもCertified Copyを取ることが多くありましたが、長期保存に適さない資料以外でもこの対応がOKとなっていることがポイントです。
初学者の方はCertified Copyについてもよく分からないと思うので、良く知らないよという方は製薬協の治験関連文書の紙原本の電子化に求められることを読むと理解が深まると思いますよ!
 のりす
のりす 私の会社でも治験関連の資料はなるべく電磁的に保管できるような体制構築をしていますよ!
クラウドシステムから電磁的記録を退避させる際の対応
治験関連の資料はAgatha等のクラウドシステムに保存することが可能とされていますが、何らかの理由によって電磁的記録を保存するクラウドシステムからファイルを退避させる場合、しっかりと同一の資料であることを担保できれば問題無いことが明記されました。
QA集では、「個々の文書にデジタル署名を行い保存するシステム」と「各種文書及び監査証跡を紐づけて保存するシステム」のそれぞれについて対応方法が記載されています。
それぞの対応で共通している留意点は以下のようなものです。
●全ての電磁的記録が漏れなく出力されること。
●監査証跡等の事実経過を検証するために必要な情報と一緒に移行して真正性、見読性、保存性を確保すること。
●旧システムと新システムのバリデーションを十分に行うこと。
 のりす
のりす ベンダーの事業廃止などでデータ移行を余儀なくされることもあるので、予めしっかりと電磁的記録退避のための手順書を整えておくことが良いですね!
私がクラウドシステムのベンダーを選定する時には、万が一の時にデータ退避ができるように汎用性についても着目して見ています。
IRBをオンライン形式で開催する際の対応
オンライン形式の治験審査委員会(IRB)について、以下の事項がしっかりと手順書に定められていれば開催可能であることが明記されました。
- 対面形式と同等の質で審議が可能であること
- 会議の開催要件
- 会議の開催方法
- 会議の運営等
COVID-19が大流行してしまい、IRBでの審議ができないという場面にも直面したのでこの辺りについても予め手順を定めておくと万が一の時に対応が可能ですよね。
 のりす
のりす ちなみに…私が管轄するプロジェクトでは施設の要件調査の時にオンライン形式のIRBの手順が定められているかをチェックリストに加えています。
以前、IRBが開催できなくなり痛い目にあったことがありましたので…
セントラルIRBでの審議の時にもこの辺りは柔軟に対応できる体制が構築されていれば依頼者としても安心ですよね。
昨今の日本の薬価制度ではドラッグラグ/ドラッグロスの本格的な再燃が危惧され、私たち臨床開発職も創意工夫を凝らした革新的な手法の確立を目指しています。 今回は日本臨床試験倫理審査機構の代表理事・一法師さんとの対談も含めてお …
まとめ
今回は令和5年9月28日付の「医薬品の臨床試験の実施の基準に関する省令の質疑応答集(Q&A)について」の主な更新内容について解説をしていきました。
今回解説をしたもの以外にも細かい更新箇所があるので、実務に関わる方は是非確認してみて下さいね!
今回はあまり更新量も多くないのですぐに読めますよ(笑

がついに始動!.jpg)





