
2023年10月17日にSMOのメディファーマが治験データ改ざん等のGCP違反をしていたことが報道されました。
今回のGCP違反は過去最大級で私がいる医薬品開発界隈にとっても非常にショッキングなニュースでした。
今回は、メディファーマによるGCP違反の情報について解説を交えながらまとめていきます。
 のりす
のりす 治験業界でかれこれ10年以上働いています。X(旧Twitter)でのフォロワー数は6,100人程。今回も分かりやすさを重視して解説をしていきます!
メディファーマの概要とSMO

株式会社メディファーマは2012年12月に設立された治験施設支援機関(Site Management Organization: SMO)です。
ヒューマグループに所属をしていた会社設立から約10年程の比較的新しいSMOでしたが、今回の違反行為があった後の2023年9月19日にヒューマグループから離脱し、社長も交代になっています。

ヒューマグループHPより抜粋

ヒューマグループHPより抜粋
 のりす
のりす 厚労省の立入検査があったのが8月29日、30日、9月4日なので立入検査後すぐにグループから離脱しているということになります…
さて、SMOというワードが出てきましたが「SMO」というワードは医薬品開発業界以外の方はあまり聞き慣れないワードかと思いますので説明をしておきます。
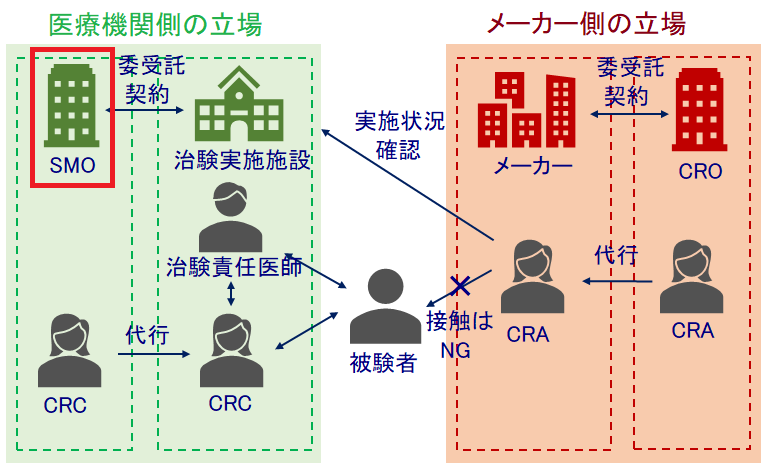
治験は大きく分けると、医療機関側の立場とメーカー側(製薬会社/医療機器会社等)の立場に分けられます。
メディファーマはSMOなので医療機関側の立場ということですね。
 のりす
のりす 「治験データ改ざん」という言葉を聞くとメーカー側が何かをやったのではないかとおもわれるかもしれませんが、今回はメーカー側の不正行為ではないことにご注意ください!!
治験は医療機関で行われますが、大学病院のように大規模な医療機関では数多くの治験が実施されており院内の治験コーディネーター(CRC)等のリソースが足りない場合があります。
その他、クリニックのような小規模な医療機関ではそもそも院内のCRCがいないこともあります。
そこで登場するのがSMOです。
リソースが確保できない医療機関は、SMOと契約を締結してCRC業務等を委託することで治験を行なっています。
メディファーマによるGCP違反の概要

2023年10月17日に厚生労働省より「株式会社メディファーマによるGCP違反について」が発出され、SMOであるメディファーマのGCP違反について報告されました。
厚生労働省によると、主な違反は以下の4点とのことです。
●呼吸機能検査の不適切な実施
●医師・施設スタッフ・CRCのIDパスワード共有、トレーニング代理受講
●治験薬保管不備の隠蔽
内容を見てみるとどれも強烈ですね…
どれ程強烈かというと、関連する治験データが使えなくなってしまう程のインパクトです。
 のりす
のりす GCPについては「不遵守」というワードはよく見かけますが、「違反」というワードを使って情報発信をしていることも個人的には気になりました。
それだけ重い事態だと認識されているということかなと思っています。
現時点で被験者さんの健康被害は無いとのことですが、それにしてもかなり大きな不正行為で信じられない程です…
GCP違反の規模
日刊薬業の記事によると、過去にメディファーマが関わった123件もの治験でデータ改ざん等が行われていたとのことです。
また、厚労省はメディファーマの創業以降約10年にわたり組織ぐるみで違反を繰り返していたとみており、その悪質さが際立っています。
 のりす
のりす 私も業界にそれなりにいますが、このレベルでのGCP違反は見たことがありません…
現時点では、全容が明らかになっていないので今後情報が更新されたらこちらの記事も併せて更新をしていこうと思います。
発覚の経緯
日刊薬業の記事では、厚生労働省に公益通報があり発覚したとのことが記載されていました。
公益通報とは、いわゆる従業員による内部告発のことです。
⇒「公益通報者保護制度の概要について」(厚生労働省)
 のりす
のりす 会社の不正を公益通報するのはとても勇気が必要だったと思います。
ただ、その勇気のおかげで被害の拡大を防ぐことができたのは非常に大きいですよね。その勇気に感謝です。
薬事承認への影響
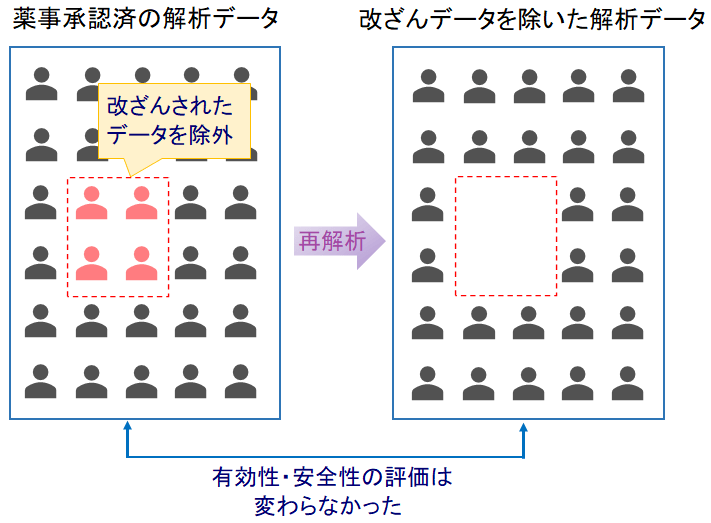
既に薬事承認を取得している医療機器と医薬品の計25製品にもデータ改ざんが含まれていたようですが、該当データを除いたとしても有効性や安全性の評価が変わることがなかったことから、現在のところは承認の取り消しの予定が無いとのことです。
ただ、現在実施中の治験があった場合は治験期間の延長にも繋がるおそれがあり製薬会社からすると大打撃となってしまう可能性もあります。
 のりす
のりす この件は、治験に参加をして下さった被験者さんのご厚意を無駄にする行為なので業界人としては決して許せません。
メディファーマのプレスリリース
プレスリリース等でしっかりと詳細を説明する前に倒産してしまいました。
説明責任もしっかりと果たさず倒産で終わりにされたのは業界で働く立場としてもモヤモヤが残りますね。
過去の主な不適切行為

メディファーマ以外のSMOでも過去に治験データを含むデータ改ざんの事例があったので簡単にですがご紹介をしておこうと思います。
ただ、今回のメディファーマのように組織ぐるみのGCP違反というのは過去にも事例があまりなく、今までの不適切事例とは次元が異なります。
過去の不適切事例も許されるものではありませんが、今回の事例がどれ程インパクトがあるのかも感じることができると思います。
一部ではありますが、過去には以下のような不適切行為がありました。
| 報告日 | 内容 |
| 2020年3月 | 治験データ改竄(体温測定部位) |
| 2019年12月 | 被験者日誌に関する不適切対応 |
| 2017年9月 | 治験データ改竄(検体採取日) |
| 2015年12月 | 被験者日誌に関する不適切対応 |
| 2013年12月 | 治験データ改竄(身長)、SMO社員が被験者として参加など |
| 報告日 | 内容 |
| 2020年3月 | 治験データ改竄(体温測定部位) |
| 2019年12月 | 被験者日誌に関する不適切対応 |
| 2017年9月 | 治験データ改竄(検体採取日) |
| 2015年12月 | 被験者日誌に関する不適切対応 |
| 2013年12月 | 治験データ改竄(身長)、SMO社員が被験者として参加など |
治験データ改竄、電子日誌(被験者日誌)の代理入力
被験者に電子日誌を貸与する試験において、被験者に代わりログイン及びチェックインを行なったり、そもそも電子日誌を貸与せずに被験者の状態をCRCが代理入力していたという事例がありました。
その他、治験実施計画書で規定された体温測定において測定部位ではない箇所で体温測定し、規定された測定部位の結果として報告をしていたという事例も同時に見つかっています。
発覚の経緯
ニュースリリースでは発覚の経緯が記載されていなかったため、確認することができませんでした。
再発防止策
この事例の再発防止策は以下のように設定されました。
- 倫理観の低下に対する教育の充実等
- コンプライアンス・ALCOA・セキュリティに対する教育の充実
- プロセス確認及び管理の徹底
- CRC 体制の強化
- 治験実施計画書の理解の向上
- 指導管理体制の強化
※詳細については参考資料をご覧下さい。
参考資料
検体採取日の改ざん
治験実施計画書で規定されている検査の欠測を補うため、CRCが単独で、規定日以外の日に検体採取を依頼し、規定日に検体が採取されたものとして測定を依頼したという事例がありました。
発覚の経緯
発覚のきっかけは、医療機関からSMOに対する問合せでした。
医療機関より検査依頼伝票に記載された採取日が数週間前の日付であったことについて事実確認を求める連絡がSMOに入りSMOによる調査の結果、不適切事例が発覚しました。
再発防止策
この事例の再発防止策は以下のように設定されました。
- 全社員に対しコンプライアンス研修を継続的に実施し、コンプライアンスの強化を図る。
- 逸脱が発生しやすい時期、状況にポイントを絞り、主担当CRCの業務を主担当CRC以外の者が定期的に確認する。
- 各CRC が担当できる主担当試験数及び1ヶ月あたりの被験者対応数の指標を定め、当該指標に基づき各施設の業務実施体制を構築する。
参考資料
被験者日誌に関する不適切対応
この不正にはCRC-AとCRC-Bの2名が関わっていました。
治験では被験者さんが記録する資料として被験者日誌がある試験があります。この被験者日誌は原則として、被験者さん本人が記載/入力することとなっています。
しかし、CRC-Aは被験者さんが鉛筆で下書きをした被験者日誌を上書きしてしまいました。
さらに、後任のCRC-Bは上書きされた被験者日誌と同じ内容になるように新しい被験者日誌に再度書き直すように被験者さんに依頼し、上書きされた被験者日誌を破棄してしまいました。
その他、CRC-Bは被験者日誌の空欄のチェックボックスにチェックを記載したり、カルテシール・被験者に日誌に記載されている数値や日時の変更や追記を計7件行ないました。
発覚の経緯
CRAによるモニタリング時に検査時刻の範囲のずれを指摘し発覚しました。
不正をしっかりと見抜けたのはお手柄でしたね。
再発防止策
この事例の再発防止策は以下のように設定されました。
- 上司による定期的なCRCの派遣先の医療機関の見回りや業務分担の見直し
- 教育資料の見直し、倫理教育の徹底
- 管理者教育
参考資料
- GCPポケット資料集2023年版
※この事例の該当SMOは統合されてしまったためか、ニュースリリースを発見することができませんでした。
治験データ改竄(身長)、SMO社員の治験参加
治験に組み入れられた被験者72名の内5名について身長データの改ざんがあった事例です。
その他、この治験には2名のSMO社員(支援SMOと同様の)が被験者として参加していたことも問題視されました。
第三者委員会による調査報告書には本件について以下のように結論付けられており、不適切行為が行われた背景について考えさせられる内容であったのが印象的でした。
期間的、条件的に被験者を確保することが困難な治験をSSIが引き受けた結果、被験者が不足する状況が生じた。
SSI 管理職が適切な対応・指示を行わなかった結果、追い詰められた現場CRCが、依頼者の要望に沿った BMIの被験者を補うために、治験責任医師の同意を得て、身長データの改ざんを行ない、他のCRCも追随したものと認められる。
「子会社における専門家調査委員会の調査結果について」より抜粋
 のりす
のりす 充実した報告書なので、こちらの報告書は是非目を通して欲しいです!
発覚の経緯
調査報告書等からは発覚の経緯は読み取れませんでした。
再発防止策
この事例の再発防止策は以下のように設定されました。
- 受注プロセスにおけるリスク評価の徹底
- 業務管理責任体制の明確化
- コンプライアンス意識の向上
- コンプライアンスに関わる問題の相談窓口の充実
- CRC 作業手順の改善提案
※詳細については参考資料をご覧下さい。
参考資料
今回の事例から感じること

今回のメディファーマのGCP違反の事例については、X内でも多くの業界の方々が発信をされています。
【重大ニュース】
厚労省からとても悲しい通知がありました。SMOのメディファーマが重大なGCP違反をしてしまったようです。
この内容はもはや会社の存続すら危うい…というよりも、治験業界にとって最悪のニュースです。 悲しいですね。(1)治験データの改竄
(2)呼吸機能検査の不適切な実施…— のりす (@Chikennochikara) October 17, 2023
CRCさんやCRAなど色々な立場の方の意見が投稿されているので、今後の業界としてのあり方を考えるご参考になるかと思います。
今回の事例については、長期間にわたり組織的に行われていたGCP違反ということで今までにない類の事例でした。
メディファーマ側のプレスリリースや全容について現時点では情報が不足しているので、あくまで現時点での暫定的な感想ですが色々と思うところがありました。
例えば、過去の不適切事例を見てみるとCRCさんが上司に相談をして発覚したというケースも見られましたが、今回の事例では約10年間、123件という規模でのGCP違反がありながらもここまで発覚してきていなかったことです。
そもそも不適切事例が起こらないようにすることが最重要ですが、不適切行為があった時に表面化しにくい構造であったことにも問題を感じました。
みなさんはこの点はどう感じましたか?
サスメドのブロックチェーン技術を導入するなどでデータ捏造の一部は機械的に防ぐことはできますが、心理的な観点からも不適切事例の背景を考えることが重要だと思います。
「そもそも今回のような不適切事例が起こらないためにはどうしたら良いか」については、また全容が分かってきてからまとめていきたいと思います。
サスメド社はブロックチェーン技術を応用して効率的かつ信頼性が高いモニタリング手法を確立するために東京医科歯科大学と共同研究をしていましたが、ついにその研究成果が報告されました。 今回は研究成果の解説とそれがどの程度治験業 …
メディファーマは不祥事後に倒産
上記のような業界でも類を見ないレベルの不適切行為があったメディファーマですが、2023年12月27日付で東京地方裁判所より破産手続の開始決定を受け倒産しました。
医薬品開発業界では、データの捏造(しかも組織ぐるみで数年にわたって)は完全に信頼を失墜するような最悪の対応です。
他の業界では「信頼回復に努め…」となるかもしれませんが、この業界ではそれが通じない程データの信頼性には重きを置いているので当たり前の結果と言えば当たり前ですね。
まとめ
今回の件については、今後詳細が分かってくるかと思いますが、大切なのは詳細を見た上で本質的なことについてもしっかりと考えていくことだと思います。
例えば、今までの不適切事例では「CRC認識不足⇒社内研修を強化する」という流れもよく見かけますが、本当にそれが根本的な解決方法だったのでしょうか?
本当は「治験データの捏造は絶対にやってはダメ」という認識はしっかりあったけど、そうせざるを得なかった状況などはなかったでしょうか?
今後、詳細が明かされたとしても問題解決の核心に迫る報告があるとも限りません。また、情報の出どころによってはバイアスがかかった情報が流れてくることもあるでしょう。
なので、私も情報に飲み込まれる前に本質をしっかりと捉えられるように心掛けていきたいと思います。







