先日の2022年7月20日、新型コロナウイルス感染症経口治療薬・ゾコーバの緊急承認の可否が医薬品第二部会で審議されましたが、継続審議となり緊急承認が見送られました。
ゾコーバの緊急承認見送りの振り返りと今の日本の治験事情について一般の方向けにお話をしていこうと思います。
 のりす
のりす ゾコーバの緊急承認見送りは残念だったね。。通常承認で結果が出ると良いね!
※本記事では、一般の方も読めるようにあえて平易な表現にしている部分もありますのでご了承下さい。
ゾコーバの緊急承認の見送り
2022年7月20日、新型コロナウイルス感染症経口治療薬・ゾコーバ(塩野義製薬)を緊急承認すべきかどうかという審議が医薬品第二部会で審議されました。
結果としては、緊急承認は見送り。
世論を見ていると「せっかく治療薬が出てきたのになんで承認しない!」や「ワクチンを打たせたい政府の陰謀」など、結構ネガティブな意見が多かったように思います。
日経新聞の社説でも緊急承認見送りの結果には否定的でしたよね。
しかし、医薬品開発界隈では世論とは対称的で緊急承認は難しいだろうと考えていました。私ももちろん。
緊急承認の条件は以下のいずれかに該当する場合が適用になります。
ここでは分かりやすさ重視で簡単に書いていますが、しっかりとした条件は「緊急承認制度における承認審査の考え方について(薬生薬審発 0520 第1号)」に載っていますのでどうぞ。
さて、緊急承認で示さなければいけない有効性(ベネフィット)と安全性(リスク)についてですが、有効性については緊急承認を申請したまでのデータから推測出来ることが求められて、安全性については有効性と比較して許容範囲内でなければいけません。
つまり、リスクとベネフィットのバランスが取れていなければいけないということです。
しかし、残念ながらゾコーバの場合は現在までのデータからは極めて高い有用性が推測できるものではなく、7/20時点では見送りという結論に至っています。
有効性や安全性については、るなさんの【ゾコーバ】塩野義の新型コロナウイルス治療薬の審査報告書を読んでみよう!【エンシトレルビル】の記事がとても分かりやすくまとめられているのでおすすめです。
ゾコーバが承認見送りとなった理由
一般の方向けなので平易に書きます。
ゾコーバが承認見送りとなった理由は一言で言うと「有効性が推定できるとは判断できないから」です。
COVID-19の特徴的な症状として以下の12症状があると言われています。
●筋肉痛又は体の痛み
●頭痛
●悪寒/発汗
●熱っぽさ又は発熱
●鼻水又は鼻づまり
●喉の痛み
●咳
●息切れ (呼吸困難)
●吐き気
●嘔吐
●下痢
ゾコーバの治験では、これら12症状の合計スコアのベースラインからの変化量をプラセボと比較するというものでした。
そして、12症状の合計スコアはプラセボと比較して有意差が出なかった(効果が無いとされた)。
しかし、塩野義は諦めずに事後解析を行い、「熱っぽさ又は発熱」、「鼻水又は鼻づまり」、「喉の痛み」、「咳」、「息切れ (呼吸困難)」の5症状について有意差が出た(有効性が推定できる)としたのですね。
上記の5症状の他にも「COVID-19 症状が快復 (消失) までの時間の短縮」と「Long COVID に関連すると考えられる症状遷延リスクの低下」を事後解析によって示しています。
5症状で有意差が出たなら良いのでは?
残念ながら当初計画をしていなかった方法での解析というのは臨床試験では基本的にはNGとなっています。
これは、後から都合の良い解析だけを公表してしまうチェリーピッキングが可能となってしまうことや解析を繰り返すことによって生じる多重性という問題(本来効果が無いものを効果があると誤った結果が出てしまう問題)が生じてしまうためです。
今回の審議でも各委員の先生からこの部分は厳しく指摘されていました。
事後解析については、すきとほるさんの事後解析、それって何がいけないの?の記事が非常に分かりやすいのでおすすめです。
具体例を書いてくれているのであまり統計を知らなくても読みやすいと思いますよ。
今の時代は有識者がブログやSNSで発信してくれているので質の良い情報が手に入って本当に良い時代になりましたね。
安全性上の懸念
直接的な理由は「有効性が推定できないから」でしたが、安全性についても指摘がありました。
PMDA(医薬品医療機器総合機構)の見解では「安全性上の大きな懸念は認められず、一定の忍容性は示されている」としながらも「本剤が製造販売後に多くの患者に使用された場合に、新たな安全性上の懸念が生じる可能性は否定できないと考える。」とされていました。
その主な要因は、非臨床の試験(動物実験)で催奇形性リスクが認められたためです。
催奇形性リスクとは、妊婦さんが投与してしまった場合に胎児に奇形を発生させるリスクのことなので、現段階では、妊婦さんはもちろん、妊娠の可能性がある方には使えないことになります。
治験では妊娠検査をしたり妊婦さんの参加がNGであったりと規制はしていますが、緊急承認がされ広く一般の方に使われるようになると妊婦さんや妊娠している方にも投与されてしまうリスクが上がってしまうのですよね。。
その他、ゾコーバは多くの薬の代謝に関与するCYP3Aという酵素の働きを阻害する作用があることから、併用禁忌の薬が多く使い勝手の悪さが指摘されていましたね。
緊急承認が成立しないことで製薬メーカーの開発意欲はそがれたか?
日経新聞の社説では以下のように記載されていました。
しかし、その有効性とは何かが明確に示されておらず、審議は従来の科学的知見にこだわったものになった。安全性に問題がないのであれば、緊急承認し、使うかどうかの判断は現場の医師や患者に委ねることもできただろう。
(中略)
名ばかりの「緊急承認制度」は製薬会社の開発意欲をそぐことにもなる。国内発のコロナ医薬品はまだ登場していない。実現がまた遠のいた。
出典:[社説]何のための薬の「緊急承認制度」なのか(日本経済新聞)
今回、ゾコーバが緊急承認見送りとなったわけですが、今回の審議の焦点は「極めて高い有効性又は安全性が推定できるか」というものでした。
何度も言いますが、医薬品の承認は政治的圧力や感情論ではなく、しっかりと科学的根拠に基づいて判断されなければいけないものです。
最近では第7波に突入し、新型コロナウイルス感染症の治療薬が強く求められているのは分かりますが、有効性が定かではない(効かないかもしれない)薬を出してしまうのはリスクが大きすぎます。
治験では特に被験者の安全性確保のために厳しい基準が設定されており、その条件下で薬を投与しますが、薬が承認されて広く一般的に使われると予期せぬ副作用が見つかることもあり、リスクが大きすぎるのです(最悪のケース、薬害にもなりかねません。加えて催奇形性のリスクもあります)。
なので、やはり医薬品はしっかりとサイエンスで語られるべきで政治的圧力や感情論では決めるべきではないと思っています。
これがもし、サイエンスは無視されて政治的な圧力や感情論で決まってしまうようなことがあれば、その方が製薬会社の開発意欲をそぐことになります。
ですので、今回の第二部会の結果を受けて製薬メーカーの開発意欲が削がれることは無いと思っています(少なくとも私は開発意欲はそがれていません)。
ちなみに、医療・社会的観点からの考えは無視して良いかというともちろんそうではなくて、PMDAも審査報告書内でも「医療・社会的観点から、本剤をより早期に使用可能とすることの検討も可能と考える。」と示しています。
”色々な事情は分かるけど、でもしっかりとサイエンスに基づいてしっかりと判断しようね”ということですね。
国産へのこだわり

色々なお話を聞いていると国産にこだわっているような意見をよく耳にします。ここで疑問なのが国産であることが果たしてそんなに大事なのかということ。
更によく聞いてみると、国産にこだわっている理由は「なんとなく安心できるから」という意見も多いように聞こえます。
では、日本で健常成人を対象にした治験で唯一治験薬との因果関係がありで死亡した事例については知っていますか?
詳細は「治験バイトで死亡」は本当?プロが実例を分かりやすく解説に書いていますが、内資系製薬メーカーのエーザイの治験で起きています(エーザイや施設の過失ではないですが)。
その他、医薬品の製造過程で睡眠薬が混入して行政処分となったのも内資系ジェネリック医薬品メーカーの小林化工でした(こちらは過失ですね)。
小林化工のヤバさについてはチクチクさんの小林化工の睡眠薬リルマザホン混入問題のまとめ【ハインリッヒの法則】が分かりやすくまとめてくれているのでおすすめ。
つまり、しっかりとした体制で開発・製造されたものでなければ国産であってもダメですし、逆に体制がしっかりとしていれば海外製でも問題無いということです。
海外で非常に有効な薬が使われているのに日本で使えないとかになったらなんか嫌じゃないですか?
Made in Japanを誇りに思う気持ちはもちろん分かりますが、海外のものでも良いものは沢山あります。「良いものは良い」と言える心構えも大事ではないでしょうか?
世界の医薬品開発の現状と日本の課題
最近の世界の医薬品開発は、国際共同治験でおこなわれることが増えてきています。
国際共同治験では、複数の国や地域で同時に治験が行われることで症例の集積スピードが上がり医薬品開発までの時間が短縮できることやドラッグラグの問題を解消できることが期待されています。
そして、日本でも国際共同治験の割合が増加しています。
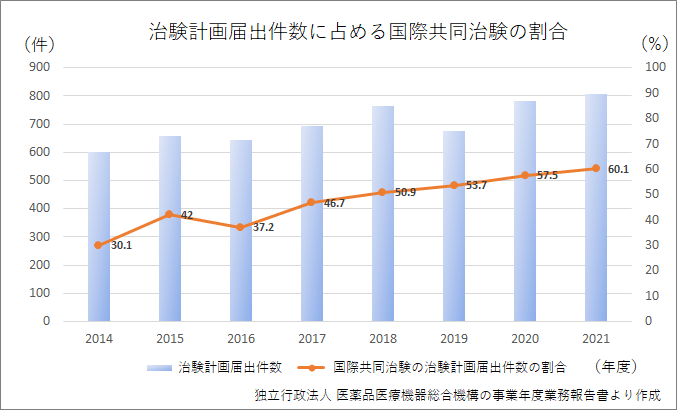
実際に平成27年~令和元年度のドラッグ・ラグの推移を見てみるとドラッグ・ラグが改善傾向にあることが分かるかと思います。
もう少し具体的にドラッグ・ラグについて見てみましょう。
| 2015年度 | 2016年度 | 2017年度 | 2018年度 | 2019年度 | |
| 開発ラグ | 1.7年 | 1.0年 | 0.2年 | 0.7年 | 0.5年 |
| 審査ラグ | 0年 | 0年 | 0.2年 | 0.2年 | 0.1年 |
| ドラッグ・ラグ | 1.7年 | 1.0年 | 0.4年 | 0.9年 | 0.6年 |
2009年頃までは、医薬品の審査のラグが1年程ありましたが、2010年以降はPMDA(医薬品医療機器総合機構)の努力によって審査ラグが大幅に改善しています。
しかし…「ドラッグ・ラグが改善している!」と手放しでは喜べないのですよね。なぜでしょうか?
ドラッグラグのもう1つの側面
2022年4月22日の参議院本会議にて岸田首相はドラッグラグの問題について、「開発ラグには年度ごとにばらつきがあり、必ずしもドラッグ・ラグが拡大しているとは言えない。」との見解をお話していました。
先ほどの2015年度~2019年度の推移を知っていてそのようにお話されたのだと思います。2015年度には1.7年のドラッグ・ラグが2019年度には0.6年ですからね、そう考えるのもしょうがないかもしれません。
ただ…
ドラッグ・ラグには「海外での承認と日本での承認に時間的な差(ラグ)がある(日本の方が使えるのが遅くなる)」という問題以外にも「海外では使える薬が日本では使えない」というもう1つの側面の問題があります。
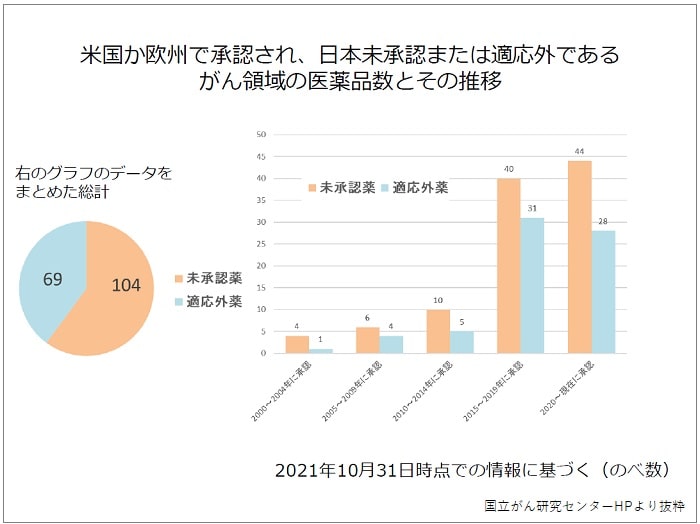
このグラフは、がん領域の医薬品について米国か欧州で承認されているが、日本では未承認になっている薬と適応外で使用している数を示したものです。
未承認薬の医薬品数がどんどん増加していますよね?
「でも、別に日本では必要ない薬だったら承認されていなかったとしても別に良いのでは?」と思うかもしれませんが、そうでもないのです。
未承認薬の増加と共に適応外薬の医薬品数も増加しています。
適応外ということは保険が効かないということですが、それでも必要なので使われている薬があるということです。保険が効かない(患者が10割負担)と経済的にも厳しいという方もいますよね?
なので、日本の医薬品未承認問題も日本の重要な課題となっているのですよね。
ちなみに、医薬品未承認問題はラグ(遅延)どころではないので、ドラッグ・ロスと呼ばれることもあります。
なぜ医薬品未承認問題が起こってしまうのか
医薬品を日本で使うためには、現状は原則日本で治験を行う必要があります。
しかし、毎年の薬価改定によって日本市場の魅力が損なわれていることと、治験をおこなう上でもコストとスピードのパフォーマンスが海外と比べると悪いことから日本で治験を行うことが敬遠されつつあるのです。
先ほど日本でも国際共同治験の割合が高くなっているとお話しましたが、海外から敬遠されることにより国際共同治験から日本が省かれてしまうということです。
日本で治験がおこなわれないということは、日本でその薬が使えないということです。
製薬メーカーが日本で治験を行わなくなると、「アメリカではこの薬は使えるのに日本では使えない…」ということが起こってしまいます。
海外では使える優秀な薬が日本で使えないとなると、患者さんにとっても大きな損失ですよね。
ではどうすれば良いのか?
グローバルから省かれないためにやるべきことは色々あります。
政府や、医療機関、そして医薬品開発に関わる各社が一丸となってその対策を考えて実行しています。
先ほど、日本の課題は「コスト」と「スピード」とお話をしました。
日本では、まだ治験に対して悪いイメージを持たれている方が一定数いますが、デマを信じずに治験に対して正しい知識を持ってもらえればとても嬉しいです。
そうすることで、治験に協力いただける方が増え、結果として日本での治験の「スピード」の向上に繋がります。
まとめ
新型コロナウイルス感染症の治療薬は私を含めて日本の多くの方が求めていると思います。
しかし、安全な医薬品を世に出す事が私たちの責務でもあるので感情論だけではなく、しっかりとしたサイエンスに基づく判断が必要不可欠です。
優れた医薬品が日本でもすぐに使えるように国際共同治験に参加することが重要ですが、そのためには日本の弱点であるコストとスピードを克服していく必要があります。
私たち製薬メーカー側の人間も当然頑張りますが、このコロナ禍の難局は国民全員で乗り越えていかなければいけないのだと思っています。皆さんの協力が必要不可欠なのです。
コロナにはもううんざりなので、早くコロナが蔓延する前の生活に戻って欲しいですね。
今回は緊急承認が見送られましたが、その背景には治験に協力して下さった沢山の被験者さん達がいます。治験に協力して下さる方にはいつも心から感謝しています。
ご協力が無駄にならないように私も頑張っていかねばですね!